Cho 21,2g hh E gồm Cu và Fe3O4 với tỉ lệ mol tương ứng là 3:1 vào 125g dd HCl 14,6%. Sau khi pứ xảy ra hoàn toàn thu được chất rắn X và dd Y a, Tính khối lượng chất rắn X b, Tính C% các chất tan trong dd Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}nCu=3x\\nFe3O4=x\end{matrix}\right.\)=>64.3x+232x=42,4
=>x=1
->n Cu=0,3, n Fe3O4=0,1 mol
Fe3O4+8HCl->2FeCl3+FeCl2+4H2O
0,1----------------------0,2
Cu+FeCl3->CuCl2+FeCl3
0,1 0,2
=>n Cu du2=0,2 mol
->m =12,8g
->C

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

Gọi số mol của FeCl2 là x
→ 127x + 58,5.2.x= 24,4 => x = 0,1.
FeCl2 + 2AgNO3 --> 2AgCl + Fe(NO3)2
0,1------>0,2--------> 0,2-------> 0,1 mol
NaCl + AgNO3 ---> AgCl + NaNO3
0,2-------> 0,2------> 0,2
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag
0,1---------------------------------> 0,1
m = (0,2 + 0,2)143,5 + 108.0,1 = 68,2 (g)
=> Đáp án A

Do ở TN2, khi tăng lượng HCl, khối lượng rắn tăng thêm
=> Trong TN1, HCl hết, kim loại dư
- Xét TN1
Theo ĐLBTKL: mA + mHCl = mrắn sau pư + mH2
=> 18,6 + 36,5.0,5a = 34,575 + 2.0,25a
=> a = 0,9
- Xét TN2:
Giả sử HCl hết
Theo ĐLBTKL: 18,6 + 0,9.36,5 = 39,9 + 0,45.2
=> 51,45 = 40,8 (vô lí)
=> HCl dư, kim loại hết
Gọi số mol Zn, Fe là a, b
=> 65a + 56b = 18,6
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--------------->a
Fe + 2HCl --> FeCl2 + H2
b---------------->b
=> 136a + 127b = 39,9
=> a = 0,2 ; b = 0,1
=> \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)

Gọi số mol KHCO3, K2O là a, b (mol)
\(n_{BaCO_3}=\dfrac{11,82}{197}=0,06\left(mol\right)\)
Bảo toàn C: \(n_{KHCO_3\left(bđ\right)}=0,06\left(mol\right)\)
=> a = 0,06 (mol)
TH1: X chứa K2CO3, KOH
PTHH: K2O + H2O --> 2KOH
b------------->2b
KOH + KHCO3 --> K2CO3 + H2O
0,06<--0,06----->0,06
=> X chứa \(\left\{{}\begin{matrix}K_2CO_3:0,06\left(mol\right)\\KOH:2b-0,06\left(mol\right)\end{matrix}\right.\)
Do 2 chất tan có cùng nồng độ mol
=> Số mol 2 chất tan bằng nhau
=> 2b - 0,06 = 0,06
=> b = 0,06 (mol)
m = 0,06.100 + 0,06.94 = 11,64 (g)
TH2: X chứa K2CO3, KHCO3
PTHH: K2O + H2O --> 2KOH
b------------->2b
KOH + KHCO3 --> K2CO3 + H2O
2b---->2b------->2b
=> X chứa \(\left\{{}\begin{matrix}KHCO_3:0,06-2b\left(mol\right)\\K_2CO_3:2b\left(mol\right)\end{matrix}\right.\)
=> 0,06 - 2b = 2b
=> b = 0,015 (mol)
=> m = 0,06.100 + 0,015.94 = 7,41 (g)

a) \(2Fe\left(OH\right)_3-^{t^o}\rightarrow Fe_2O_3+3H_2O\)
\(Cu\left(OH\right)_2-^{t^o}\rightarrow CuO+H_2O\)
Gọi x,y lần lượt là số mol Fe(OH)3 và Cu(OH)2
=> \(\left\{{}\begin{matrix}107x+98y=20,5\\160.\dfrac{x}{2}+80y=16\end{matrix}\right.\)
=> x= 0,1 ; y=0,1
=> \(\%m_{Fe\left(OH\right)_3}=\dfrac{0,1.107}{20,5}.100=52,2\%\)
\(\%m_{Cu\left(OH\right)_2}=47,8\%\)
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
\(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
\(n_{H_2SO_4}=0,1.\dfrac{3}{2}+0,1=0,25\left(mol\right)\)
\(m_{ddH_2SO_4}=\dfrac{0,25.98}{20\%}=122,5\left(g\right)\)
\(m_{ddsaupu}=20,5+122,5=143\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{143}.100=13,97\%\)
\(C\%_{CuSO_4}=\dfrac{0,1.160}{143}.100=11,19\%\)
c) \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{Fe_2O_3}=0,05\left(mol\right);n_{CuO}=0,1\left(mol\right)\)
=> \(n_{H_2SO_4}=0,05.3+0,1=0,25\left(mol\right)\)
\(m_{ddH_2SO_4\left(pứ\right)}=\dfrac{0,25.98}{20\%}=122,5\left(g\right)\)
=> \(m_{ddH_2SO_4\left(bđ\right)}=122,5.110\%=134,75\left(g\right)\)
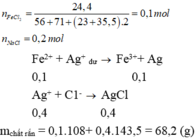
Gọi \(n_{Fe_3O_4}=a\left(mol\right)\rightarrow n_{Cu}=3a\left(mol\right)\)
\(232a+64.3a=21,2\\ \Leftrightarrow a=0,05\left(mol\right)\)
\(m_{HCl}=125.14,6\%=18,25\left(g\right)\)
PTHH:
Fe3O4 + 8HCl ---> FeCl2 + 2FeCl3 + 4H2O
0,05------>0,4------->0,05---->0,1
\(m_X=0,05.3.64=9,6\left(g\right)\)
\(m_{dd}=232.0,05+125=136,6\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,05.127}{136,6}.100\%=4,65\%\\C\%_{FeCl_3}=\dfrac{0,1.162,5}{136,6}.100\%=11,9\%\\C\%_{HCl\left(dư\right)}=\dfrac{18,25-0,4.36,5}{136,6}=2,67\%\end{matrix}\right.\)