Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi hòa tan Y vào dd HCl dư thu được chất rắn
=> Chất rắn là lưu huỳnh
mS(dư) = 1,2 (g)
\(n_{CuS}=\dfrac{14,4}{96}=0,15\left(mol\right)\) => nS(Z) = 0,15 (mol)
Bảo toàn S: mS(X) = 1,2 + 0,15.32 = 6 (g)

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Ta có:
\(n_{Na2S}=\frac{7,8}{78}=0,1\left(mol\right)\)
\(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
\(H_2S+2NaOH\rightarrow Na_2S+H_2O\)
\(\left\{{}\begin{matrix}n_{Fe\left(bđ\right)}=\frac{11,2}{56}=0,2\left(mol\right)\\n_{S\left(bđ\right)}=\frac{4,8}{32}=0,15\left(mol\right)\end{matrix}\right.\)
\(PTHH:Fe+S\rightarrow FeS\)
Ban đầu : _0,2___0,15_____
Phứng : __0,15____0,15_____
Sau: _____0,05_____0________
\(\Rightarrow H=\frac{0,1}{0,15}.100=66,67\%\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)

Đáp án : D
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%
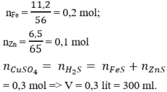
\(m_{ko.tan}=m_S=\dfrac{1,2}{32}=0,0375\left(mol\right)\)
\(n_{CuS}=\dfrac{14,4}{96}=0,15\left(mol\right)\)
PTHH:
H2S + CuSO4 ---> CuS + H2SO4
0,15<-----------------0,15
FeS + 2HCl ---> FeCl2 + H2S
0,15<-------------------------0,15
Fe + S --to--> FeS
0,15<----0,15
\(m_S=\left(0,0375+0,15\right).32=6\left(g\right)\)