Cho 160 gam dung dịch CuSO4 nồng độ 10%phản ứng với 150 gam dung dịch NaOH 8%, thu được m gam kết tủa Cu(OH)2và dung dịch X. Tính m và nồng độ phần trăm mỗi chất tan trong dung dịch X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2SO_4}=\dfrac{200.19,6}{100.98}=0,4mol\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4\left(A\right)}=n_{CuO}=n_{H_2SO_4}=0,4mol\\ n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\\\Rightarrow\dfrac{0,4}{1}>\dfrac{0,3}{1}\Rightarrow CuSO_4.pư.không.hết\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,3mol 0,6mol 0,3mol
\(m_{ddB}=0,4.80+200+0,6.40-29,4=226,6g\\ C_{\%Na_2SO_4\left(B\right)}=\dfrac{0,3.142}{226,6}\cdot100=18,8\%\)

a, Gọi \(m_{NaCl\left(thêm\right)}=a\left(g\right)\)
\(m_{NaCl\left(bđ\right)}=5\%.100=5\left(g\right)\\ \Rightarrow C\%_{NaCl}=\dfrac{5+a}{100+a}.100\%=5,5\%\\ \Leftrightarrow a=0,53\left(g\right)\)
b, \(m_{NaCl}=58,5.5,5\%=3,2175\left(g\right)\\ n_{NaCl}=\dfrac{3,2175}{58,5}=0,055\left(mol\right)\)
PTHH: NaCl + AgNO3 ---> AgCl↓ + NaNO3
0,055-->0,055------>0,055---->0,055
\(m_{AgCl}=0,055.143,5=7,8925\left(g\right)\\ m_{ddY}=58,5+200-7,8925=250,6075\left(g\right)\\ \Rightarrow C\%_{NaNO_3}=\dfrac{0,055.85}{250,6075}.100\%=1,87\%\)

Ta có: \(n_{H_2SO_4}=\dfrac{200.19,6\%}{98}=0,4\left(mol\right)\)
\(n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Dung dịch A gồm: CuSO4 và H2SO4 dư
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Đề có cho dữ kiện gì liên quan đến dd NaOH không bạn nhỉ?

\(a,2NaOH+MgSO_4\rightarrow Mg\left(OH\right)_2+Na_2SO_4\\ n_{NaOH}=0,5.1=0,5\left(mol\right)\\ b,n_{Mg\left(OH\right)_2}=\dfrac{0,5}{2}=0,25\left(mol\right)=n_{Na_2SO_4}\\ m_{kt}=m_{Mg\left(OH\right)_2}=58.0,25=14,5\left(g\right)\\ c,V_{ddX}=V_{ddNaOH}+V_{ddMgSO_4}=0,5+0,5=1\left(l\right)\\ C_{MddNa_2SO_4}=\dfrac{0,25}{1}=0,25\left(M\right)\)

MgCl2+2AgNO3->Mg(NO3)2+2AgCl
0,04-----0,08-----------0,04----------0,08
n MgCl2=0,1 mol
n AgNO3=0,08 mol
=>Mgcl2 dư
=>m AgCl=0,08.143,5=11,48g
=>CMMg(NO)2=\(\dfrac{0,04}{0,2}\)=0,2M
=>CMMgcl2 dư=\(\dfrac{0,06}{0,2}\)=0,3M
\(n_{MgCl_2}=0,1\cdot1=0,1mol\)
\(n_{AgNO_3}=0,1\cdot0,8=0,08mol\)
\(MgCl_2+2AgNO_3\rightarrow2AgCl\downarrow+Mg\left(NO_3\right)_2\)
0,1 0,08 0 0
0,04 0,08 0,08 0,04
0,06 0 0,08 0,04
\(m_{\downarrow}=0,08\cdot143,5=11,48g\)
\(C_{M_{Mg\left(NO_3\right)_2}}=\dfrac{n_{Mg\left(NO_3\right)_2}}{V_X}=\dfrac{0,04}{0,2}=0,2M\)

nNa = 6.9 : 23 = 0.3 mol
4Na + O2 ->2 Na2O
mol : 0.3 -> 0.15
Na2O + H2O -> 2NaOH
mol : 0.15 -> 0.3
mdd = 0.15 x 62 + 140.7 = 150g
C% NaOH = 0.3x40: 150 x 100% = 8%

\(m_{FeCl_3}=\dfrac{100\cdot13\%}{100\%}=13\left(g\right)\\ \Rightarrow n_{FeCl_3}=\dfrac{13}{162,5}=0,08\left(mol\right)\\ a,\text{Hiện tượng: Màu vàng nâu của dung dịch }FeCl_3\text{ nhạt dần và xuất hiện kết tủa màu nâu đỏ }Fe\left(OH\right)_3\\ PTHH:3NaOH+FeCl_3\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\\ \Rightarrow n_{NaOH}=3n_{FeCl_3}=0,24\left(mol\right)\\ \Rightarrow m_{CT_{NaOH}}=0,24\cdot40=9,6\left(g\right)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{9,6\cdot100\%}{10\%}=96\left(g\right)\)\(b,n_{Fe\left(OH\right)_3}=0,08\left(mol\right);n_{NaCl}=0,24\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{Fe\left(OH\right)_3}=0,08\cdot107=8,56\left(g\right)\\m_{NaCl}=0,24\cdot58,5=14,04\left(g\right)\end{matrix}\right.\\ \Rightarrow m_{dd_{NaCl}}=96+100-8,56=187,44\left(g\right)\\ \Rightarrow C\%_{NaCl}=\dfrac{14,04}{187,44}\cdot100\%\approx7,49\%\)
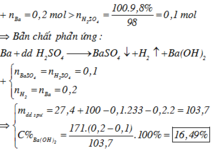
\(n_{CuSO_4}=\dfrac{160.10\%}{160}=0,1\left(mol\right)\)
\(n_{NaOH}=\dfrac{150.8\%}{40}=0,3\left(mol\right)\)
PTHH: CuSO4 + 2NaOH --> Cu(OH)2 + Na2SO4
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\) => CuSO4 hết, NaOH dư
PTHH: CuSO4 + 2NaOH --> Cu(OH)2 + Na2SO4
0,1------>0,2------->0,1------->0,1
=> m = 0,1.98 = 9,8 (g)
\(\left\{{}\begin{matrix}m_{NaOH_{dư}}=\left(0,3-0,2\right).40=4\left(g\right)\\m_{Na_2SO_4}=0,1.142=14,2\left(g\right)\end{matrix}\right.\)
mdd sau pư = 160 + 150 - 9,8 = 300,2 (g)
\(\left\{{}\begin{matrix}C\%_{NaOH_{dư}}=\dfrac{4}{300,2}.100\%=1,33\%\\C\%_{Na_2SO_4}=\dfrac{14,2}{300,2}.100\%=4,73\%\end{matrix}\right.\)
\(m_{CuSO_4}=\dfrac{160.10}{100}=16\left(g\right)\\ n_{NaOH}=\dfrac{8.150}{100}=12\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\\n_{NaOH}=\dfrac{12}{40}=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: 2NaOH + CuSO4 ---> Cu(OH)2 + Na2SO4
LTL: \(0,1< \dfrac{0,3}{2}\rightarrow\) NaOH dư
Theo pt: \(\left\{{}\begin{matrix}n_{NaOH\left(pư\right)}=\dfrac{1}{2}n_{CuSO_4}=2.0,1=0,2\left(mol\right)\\n_{Na_2SO_4}=n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\rightarrow m=0,1.98=9,8\left(g\right)\\ m_{dd}=160+150-9,8=300,2\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}C\%_{NaOH\left(dư\right)}=\dfrac{\left(0,3-0,2\right).40}{300,2}=1,33\%\\C\%_{Na_2SO_4}=\dfrac{0,1.142}{300,2}=4,73\%\end{matrix}\right.\)