Khử 104m4g oxit Kim loại r chưa rõ hoá trị cần vừa đủ vh2 .sau phản ứng thu được 75.6g kim loại tìm kim loại r và giá trị của v
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
$n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Gọi CTHH của oxit là $R_2O_n$
$R_2O_n + nH_2 \xrightarrow{t^o} 2R + nH_2O$
Theo PTHH : $n_{H_2O} = n_{H_2} = 0,06(mol)$
Bảo toàn khối lượng : $m_{oxit} + m_{H_2} = m_{kim\ loại} + m_{H_2O}$
$\Rightarrow m_{kim\ loại} = 3,2 + 0,06.2 - 0,06.18 = 2,24(gam)$
b)
Theo PTHH : $n_{R_2O_n} = \dfrac{1}{n}.n_{H_2} = \dfrac{0,06}{n}(mol)$
$\Rightarrow \dfrac{0,06}{n}.(2R + 16n) = 3,2$
$\Rightarrow R = \dfrac{56}{3}n$
Với n = 3 thì n = 56(Fe)
Vậy kim loại là Fe, oxit là $Fe_2O_3$

Tham khảo:
Gọi công thức của oxit là RO
PTHH: RO + H2 t0→→t0 R + H2O
nH2=2,2422,4=0,1(mol)
Theo PTHH: nRO = nH2 = 0,1 (mol)
=> (R + 16).0,1 = 8
=> R + 16 = 80
=> R = 64 (Cu)
Chúc em học giỏi

a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe +3 CO_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$RO + H_2 \xrightarrow{t^o} R + H_2O$
b)
Coi m = 160(gam)$
Suy ra: $n_{Fe_2O_3} = 1(mol)$
Theo PTHH :
$n_{RO} = n_{H_2} = n_{Fe} = 2n_{Fe_2O_3} = 2(mol)$
$M_{RO} = R + 16 = \dfrac{160}{2} = 80 \Rightarrow R = 64(Cu)$
Vậy oxit là CuO

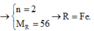
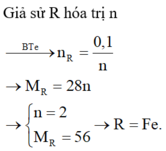
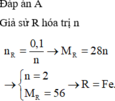
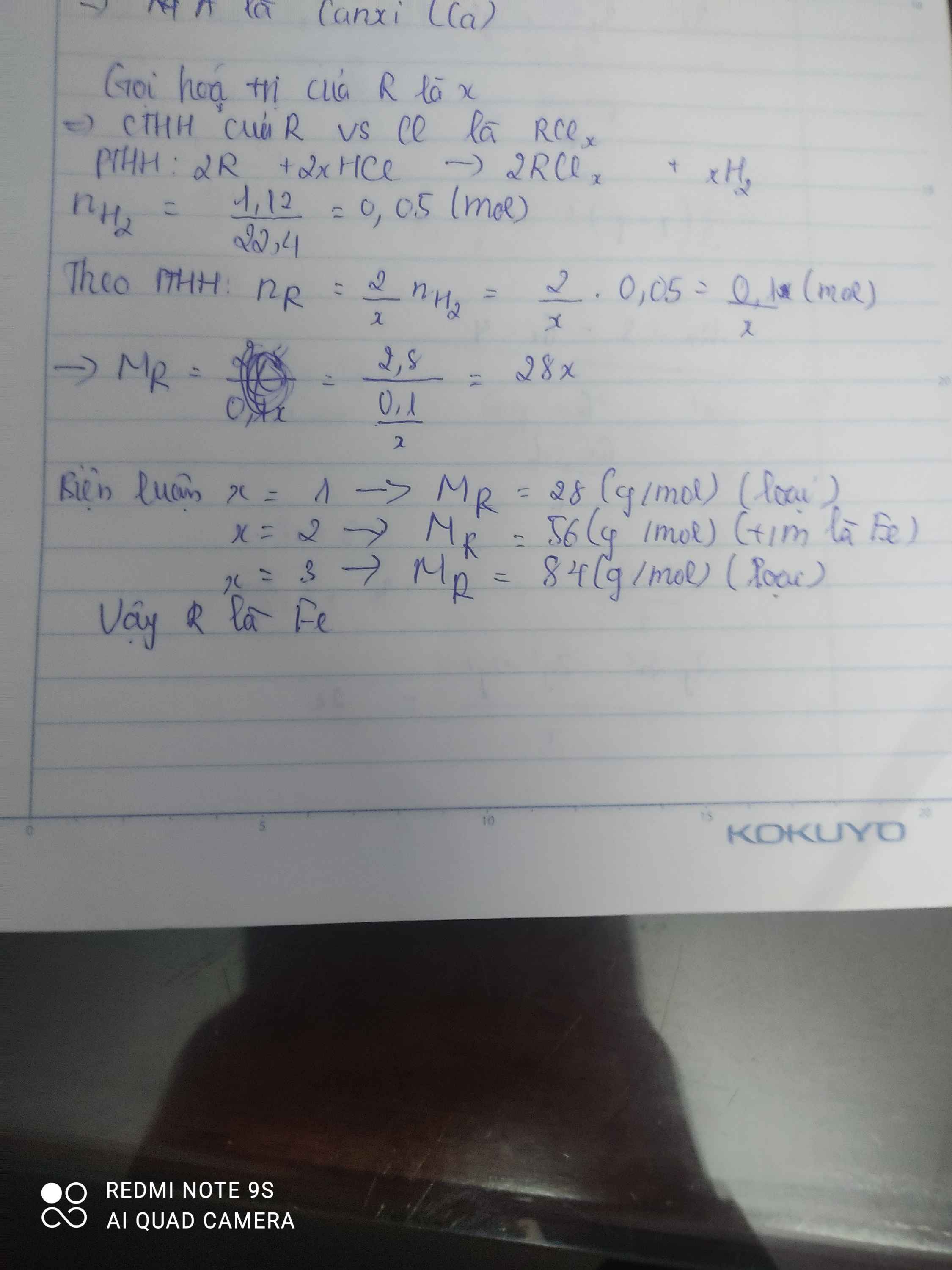
\(n_R=\dfrac{75,6}{M_R}mol\)
\(n_{R_2O_n}=\dfrac{104,4}{2M_R+16n}mol\)
\(R_2O_n+H_2\rightarrow\left(t^o\right)2R+nH_2O\)
\(\dfrac{104,4}{2M_R+16n}\) -----> \(\dfrac{208,8}{2M_R+16n}\) ( mol )
\(\Rightarrow\dfrac{208,8}{2M_R+16n}=\dfrac{75,6}{M_R}\)
\(\Leftrightarrow208,8M_R=151,2M_R+1209,6n\)
\(\Leftrightarrow57,6M_R=1209,6n\)
\(\Leftrightarrow M_R=21n\)
Xét :
n=1 => Loại
n=2 => Loại
n=3 => Loại
\(n=\dfrac{8}{3}\) => R là sắt ( Fe )
Vậy Kim loại đó là sắt ( Fe )
\(\Rightarrow n_{H_2}=\dfrac{75,6}{2.56}=0,675mol\)
\(V_{H_2}=0,675.22,4=15,12l\)
104m4g?