1) đốt cháy 32,4g Al trong khí O² thu được nhôm oxit (Al²O³).
a) Viết phương trình phản ứng
b) tính thể tích khí O² cần dùng (ở đktc)
c) Tính khối lượng nhôm oxit thu được theo 2 cách.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

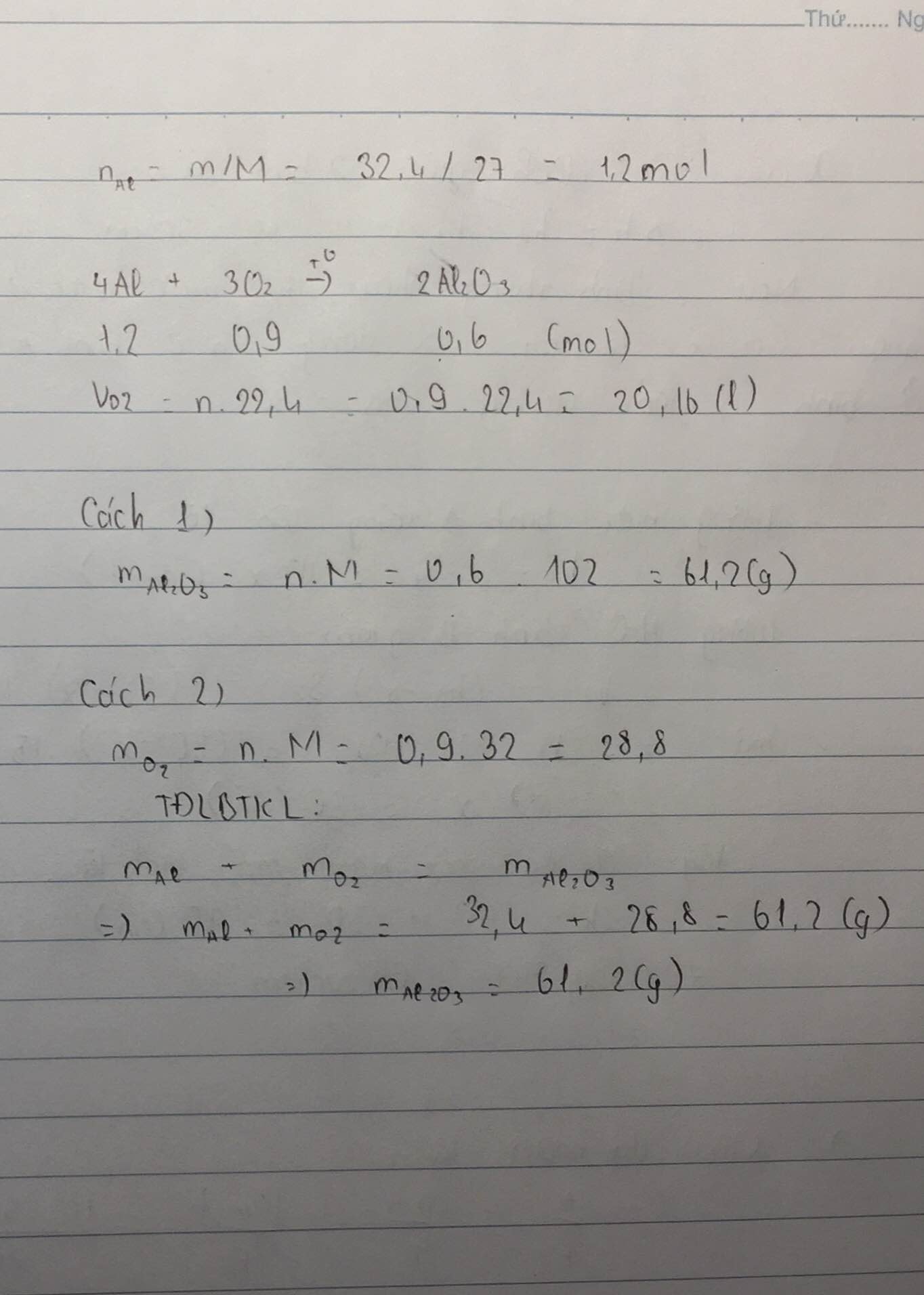

a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
c, Theo PT: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)

a) PTHH: 4Al + 3O2 =(nhiệt)=> 2Al2O3
nAl = \(\frac{5,4}{27}=0,2\left(mol\right)\)
b) nO2 = \(\frac{0,2\times3}{4}=0,15\left(mol\right)\)
=> VO2(đktc) = 0,15 x 22,4 = 3,36 lít
c) nAl2O3 = \(\frac{0,2\times2}{4}=0,1\left(mol\right)\)
=> mAl2O3 = 0,1 x 102 = 10,2 gam

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\a, 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{O_2}=\dfrac{3}{4}.0,2=0,15\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\)

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ a,4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ b,n_{O_2}=\dfrac{3}{4}.0,2=0,15\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,15.22,4=3,36\left(l\right)\)

a) \(4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3\)
b)
\(n_{Al} = \dfrac{21,6}{27} = 0,8(mol)\)
Theo PTHH :
\(n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 0,4(mol)\\ \Rightarrow m_{Al_2O_3} = 0,4.102 = 40,8(gam)\)
c)
\(n_{O_2} = \dfrac{3}{4}n_{Al} = 0,6(mol)\\ \Rightarrow V_{O_2} = 0,6.22,4 = 13,44(lít)\\ \Rightarrow V_{không\ khí} = 5V_{O_2} = 13,44.5 = 67,2(lít)\)

\(n_{Al}=\dfrac{5,4}{54}=0,1(mol)\\ 4Al+3O_2\xrightarrow{t^o}2Al_2O_3\\ \Rightarrow n_{O_2}=\dfrac{3}{4}n_{Al}=0,075(mol);n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,05(mol)\\ \Rightarrow V_{O_2}=0,075.22,4=1,68(l);m_{Al_2O_3}=0,05.102=5,1(g)\)

nAl2O3 = m/M=10,2/102=0,1(mol)
a) PTHH: 4Al + 3O2 = 2Al2O3
Theo phản ứng: 4 3 2 (mol)
Theo bài ra: 0,2 0,15 0,1 (mol)
b) mAl= n.M=0,2.27=5,4(g)
c) VO2 = n.22,4=0,15.22,4=3,36(l)
hok tốt

nAl = 2,7/27 = 0,1 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,1 ---> 0,075 ---> 0,05
mAl2O3 = 0,05 . 102 = 5,1 (g)
VO2 = 0,075 . 22,4 = 1,68 (l)
Vkk = 1,68 . 5 = 8,4 (l)
\(n_{Al}=\dfrac{m_{Al}}{M_{Al}}=\dfrac{2,7}{27}=0,1mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,1 0,075 0,05 ( mol )
\(m_{Al_2O_3}=n_{Al_2O_3}.M_{Al_2O_3}=0,05.102=5,1g\)
\(V_{kk}=V_{O_2}.5=\left(0,075.22,4\right).5=8,4l\)

a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{Al_2O_3}=0,3\left(mol\right)\Rightarrow V_{O_2}=0,3.22,4=6,72\left(l\right)\)
c, \(V_{kk}=\dfrac{V_{O_2}}{20\%}=33,6\left(l\right)\)