Hòa tan hoàn toàn a gam sắt vào axit HCl thu được 3,36 lít khí. Hòa tan hết cũng a gam sắt vào axit H2SO4 đặc, nóng, dư thu được x lít khí. Còn khi hòa tan hết a gam sắt vào HNO3 loãng, dư thu được y lít khí NO. Tính x, y đo ở cùng điều kiện
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (1)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\) (2)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (3)
Ta có: \(n_{H_2}=0,2\left(mol\right)\)
Theo PT (1): \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Theo PT (2): \(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Theo PT (3): \(n_{KMnO_4}=\dfrac{2}{5}n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow V_{KMnO_4}=\dfrac{0,12}{2}=0,06\left(l\right)\)
Bạn tham khảo nhé!

Chọn A
Coi A gồm x mol Fe và y mol O.
Sục khí Cl2 cho đến dư vào X thu được dung dịch Y chứa 9,75 gam muối tan muối tan chính là FeCl3
x= nFeCl3= 0,06 mol.
y= 0,04 mol.
Cho A vào HNO3 thì có quá trình:
+ Cho e : Fe → Fe+3 + 3e
+ Nhận e:
N+5 + 3e → N+2
O + 2e → O-2
→ 3nNO + 2nO = 3nFe
→ VNO = 22,4. nNO = 22,4. 0,33=0,747 l

a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=n_{H_2}=0,15\left(mol\right)\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
b, \(n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=0,2\left(mol\right)\Rightarrow C_{M_{NaOH}}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)
\(a,n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,15 0,3 0,15 0,15
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(a,n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\)
PTHH :
\(Na_2O+H_2O\rightarrow2NaOH\)
0,1 0,1 0,2
\(C_{M\left(A\right)}=\dfrac{0,2}{0,5}=0,4\left(M\right)\)

$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)

Gọi số mol N2O, N2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{44a+28b}{a+b}=18,45.2=36,9\left(g/mol\right)\)
=> 7,1a = 8,9b (1)
PTHH: 8Fe + 30HNO3 --> 8Fe(NO3)3 + 3N2O + 15H2O
\(\dfrac{8}{3}a\)<-------------------------------a
10Fe + 36HNO3 --> 10Fe(NO3)3 + 3N2 + 18H2O
\(\dfrac{10}{3}b\)<------------------------------b
=> \(\dfrac{8}{3}a+\dfrac{10}{3}b=\dfrac{4,48}{22,4}=0,2\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{89}{2370}\left(mol\right)\\b=\dfrac{71}{2370}\left(mol\right)\end{matrix}\right.\) => \(V=\left(\dfrac{89}{2370}+\dfrac{71}{2370}\right).22,4=\dfrac{1792}{1185}\left(l\right)\)
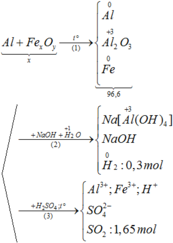
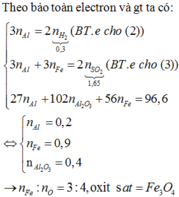


Giả sử có u (mol) Fe
TN1:
PTHH: Fe + 2HCl --> FeCl2 + H2
u--------------------->u
=> \(n_{H_2}=u\left(mol\right)\)
TN2:
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
u------------------------------>1,5u
=> \(n_{SO_2}=1,5u\left(mol\right)\)
Có: \(\dfrac{V_{SO_2}}{V_{H_2}}=\dfrac{n_{SO_2}}{n_{H_2}}=\dfrac{1,5u}{u}=1,5\Rightarrow V_{SO_2}=1,5.3,36=5,04\left(l\right)\)
TN3:
PTHH: Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
u-------------------------->u
=> \(n_{NO}=u\left(mol\right)\)
Có: \(\dfrac{V_{NO}}{V_{H_2}}=\dfrac{n_{NO}}{n_{H_2}}=\dfrac{u}{u}=1\Rightarrow V_{NO}=3,36\left(l\right)\)