cho từ từ 3,25 gam kẽm viên vào 120ml dung dịch hcl 1m.tính thể tích khí hidro sinh ra ở đktc.trình bày cách làm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 3:
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right);n_{H_2SO_4}=0,45.1=0,45\left(mol\right)\\ PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Vì:\dfrac{0,2}{2}< \dfrac{0,45}{3}\Rightarrow H_2SO_4dư\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{n_{Al}}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ m_{muối}=m_{Al_2\left(SO_4\right)_3}=342.0,1=34,2\left(g\right)\)
Bài 2:
\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right);n_{HCl}=0,12.1=0,12\left(mol\right)\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,05}{1}< \dfrac{0,12}{2}\Rightarrow HCldư\\ n_{H_2}=n_{Zn}=0,05\left(mol\right)\\ V_{H_2\left(đkc\right)}=0,05.24,79=1,2395\left(l\right)\)

nZn = \(\dfrac{3,25}{65}=0,05\) mol
nHCl = 1 . 0,12 = 0,12 mol
Pt: Zn + 2HCl --> ZnCl2 + H2
0,05 mol--------------------> 0,05 mol
Xét tỉ lệ mol giữa Zn và HCl:
\(\dfrac{0,05}{1}< \dfrac{0,12}{2}\)
Vậy HCl dư
VH2 sinh ra = 0,05 . 22,4 = 1,12 (lít)

1: \(n_{Zn}=\dfrac{3.25}{65}=0.05\left(mol\right)\)
a: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,05 0,1 0,05 0,05
\(m_{dd\left(HCl\right)}=0.1\cdot36.5=3.65\left(g\right)\)
b: \(V_{H_2}=0.05\cdot22.4=1.12\left(lít\right)\)
2)
H3PO4 (axit yếu) : axit photphoric
Zn3(PO4)2 (muối) : kẽm photphat
Fe2(SO4)3 (muối) : sắt (III) sunfat
SO2 (oxit axit) : lưu huỳnh đioxit
SO3 (oxit axit) : lưu huỳnh trioxit
P2O5 (oxit axit) : đi photpho pentaoxit
HCl(axit mạnh) : axit clohidric
Ca(HCO3)2 (muối axit) : canxi hidrocacbonat
Ca(H2PO4)2 (muối aixt) : canxi đihidrophotphat
Fe2O3 (oxit bazơ) : sắt (III) oxit
Cu(OH)2 (bazơ) : đống(II) hidroxit
NaH2PO4 (muối axit) : natri đihidrophotphat
Chúc bạn học tốt

* Tóm tắt:
Biết: mZn = 6,5 (g)
CM(dd.HCl) = 0,5M
Hỏi: a) VH2 = ?
b) Vdd HCl = ?
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,1-->0,2------------->0,1
VH2 = 0,1.22,4 = 2,24 (l)
b) \(V_{\left(dd.HCl\right)}=\dfrac{0,2}{0,5}=0,4\left(l\right)\)

`Zn + 2HCl -> ZnCl_2 + H_2`
`0,1` `0,2` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C%_[HCl]=[0,2.36,5]/200 . 100 =3,65%`
`Zn + HCl -> ZnCl_2 + H_2` `\uparrow`
`n_(Zn) = (6,5)/65 = 0,1 mol`.
`n_(H_2) = 0,1 mol`.
`V(H_2) = 0,1 xx 22,4 = 2,24l`.
`C%(HCl) = (0,2.36,5)/200 xx 100 = 36,5%`.
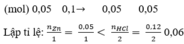



\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\\ n_{HCl}=0,12.1=0,12\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
LTL: \(0,05< \dfrac{0,12}{2}\rightarrow\) HCl dư
Theo pthh: \(n_{H_2}=n_{Zn}=0,05\left(mol\right)\)
=> VH2 = 0,05.22,4 = 1,12 (l)
refer