cho dung dịch HCl 2M pứ với dung dịch NaOH 0,3M theo tỉ lệ 1:3 tính CM dung dịch thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Gọi thể tích dung dịch A là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch B là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
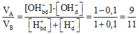

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11


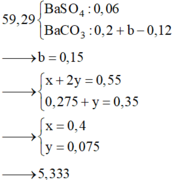
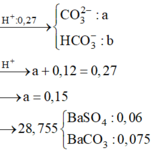
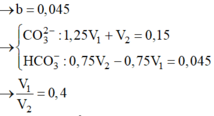
Gọi \(V_{HCl}=a\left(l\right)\)
\(\rightarrow V_{NaOH}=3a\left(l\right)\)
\(\rightarrow\left\{{}\begin{matrix}n_{HCl}=2a\left(mol\right)\\n_{NaOH}=0,3.3a=0,9a\left(mol\right)\end{matrix}\right.\)
PTHH: NaOH + HCl ---> NaCl + H2O
LTL: \(0,9a< \dfrac{2a}{2}\rightarrow\) HCl dư
Theo pthh: \(\left\{{}\begin{matrix}n_{HCl\left(pư\right)}=2n_{NaOH}=2.0,9a=1,8a\left(mol\right)\\n_{NaCl}=n_{NaOH}=0,9a\left(mol\right)\end{matrix}\right.\)
\(V_{dd\left(sau.pư\right)}=a+3a=4a\left(l\right)\)
=> \(\left\{{}\begin{matrix}C_{M\left(HCl.dư\right)}=\dfrac{2a-1,8a}{4a}=0,05M\\C_{M\left(NaCl\right)}=\dfrac{0,9a}{4a}=0,225M\end{matrix}\right.\)
Tỉ lệ 1 : 3 về cái gì ?