Cho một dung dịch có hòa tan 13,6 gam AgNO3 tác dụng với một dung dịch có hòa tan hai muối NaCl và KCl ,thu được 9,471 gam kết tủa với dung dịch A.Chứng minh rằng AgNO3 còn dư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
Gọi số mol NaCl, KCl là a, b (mol)
=> 58,5a + 74,5b = 6,81 (1)
\(n_{AgCl}=\dfrac{14,35}{143,5}=0,1\left(mol\right)\)
Bảo toàn Cl: a + b = 0,1 (2)
(1)(2) => a = 0,04 (mol); b = 0,06 (mol)
\(\left\{{}\begin{matrix}m_{NaCl}=0,04.58,5=2,34\left(g\right)\\m_{KCl}=0,06.74,5=4,47\left(g\right)\end{matrix}\right.\)
Câu 2:
Gọi số mol MgCl2, KCl là a, b (mol)
=> 95a + 74,5b = 3,93 (1)
25ml dd A chứa \(\left\{{}\begin{matrix}MgCl_2:0,05a\left(mol\right)\\KCl:0,05b\left(mol\right)\end{matrix}\right.\)
nAgNO3 = 0,05.0,06 = 0,003 (mol)
=> nAgCl = 0,003 (mol)
Bảo toàn Cl: 0,1a + 0,05b = 0,003 (2)
(1)(2) => a = 0,01 (mol); b = 0,04 (mol)
\(\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,01.95}{3,93}.100\%=24,173\%\\\%m_{KCl}=\dfrac{0,04.74,5}{3,93}.100\%=75,827\%\end{matrix}\right.\)

a)
$NaCl + AgNO_3 \to AgCl + NaNO_3$
$KCl + AgNO_3 \to AgCl + KNO_3$
$n_{AgNO_3} = \dfrac{13,6}{170} = 0,08 >n_{AgCl} = \dfrac{9,471}{143,5} = 0,066(mol)$
Do đó $AgNO_3$ dư.
$n_{NaCl } + n_{KCl} = n_{AgCl} = 0,066(mol)$
b)
$n_{AgNO_3\ pư} = n_{AgCl} = 0,066(mol)$
$n_{AgNO_3\ dư} = 0,08 - 0,066 = 0,014(mol)$
$Cu + 2AgNO_3 \to Cu(NO_3)_2 + 2Ag$
$n_{Ag} = n_{AgNO_3} = 0,066(mol)$
$n_{Cu} = \dfrac{1}{2}n_{AgNO_3} = 0,007(mol)$
$m_{Ag} - m_{Cu} = 0,014.108 -0,007.64 = 1,064(gam)$
Do đó, lá đồng tăng 1,064 gam

a) Dung dịch sau phản ứng tác dụng được với Cu
⇒\( AgN{O_3} \) dư, muối clorua phản ứng hết
Bảo toàn nguyên tố Cl:
\({n_{NaCl}} + {n_{KCl}} = {n_{AgCl}} = \dfrac{{9,471}}{{143,5}} = 0,066mol\)
b) \({n_{AgN{O_3}pu}} = {n_{AgCl}} = 0,066mol\)
\(\Rightarrow {n_{AgN{O_3}du}} = 0,08 - 0,066 = 0,014mol \)
\(Cu + 2AgN{O_3} \to Cu{(N{O_3})_2} + 2Ag\)
\({n_{Cupu}} = \dfrac{1}{2}{n_{AgN{O_3}du}} = 0,007mol \)
\(\Rightarrow {m_{Cu\tan g}} = {m_{Ag}} - {m_{Cupu}} = 0,014.108 - 0,007.64 = 1,064g \)

Chúc bạn học tốt !!!
\(m_{hh}=74.5a+58.5b=26.6\left(g\right)\left(1\right)\)
\(n_{AgCl}=\dfrac{57.4}{143.5}=0.4\left(mol\right)\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(n_{AgCl}=a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.2\)
\(m_{dd\left(saupư\right)}=26.6+500-57.4=469.2\left(g\right)\)
\(C\%_{KNO_3}=\dfrac{0.2\cdot101}{469.2}\cdot100\%=4.31\%\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{469.2}\cdot100\%=3.62\%\)


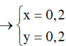
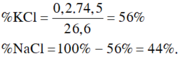
\(\left\{{}\begin{matrix}n_{NaCl}=x\left(mol\right)\\n_{KCl}=y\left(mol\right)\end{matrix}\right.\)
\(n_{AgNO_3}=\dfrac{13,6}{170}=0,08mol\)
\(n_{AgCl\downarrow}=\dfrac{9,471}{143,5}=0,066mol\)
\(AgNO_3+NaCl\rightarrow AgCl\downarrow+NaNO_3\)
x x
\(AgNO_3+KCl\rightarrow AgCl\downarrow+KNO_3\)
y y
Mà \(\Sigma n_{AgCl}=x+y=0,066mol\)
\(\Sigma n_{AgNO_3}=x+y=0,08>\Sigma n_{AgCl}\)
\(\Rightarrow AgNO_3\) dư và dư 0,08-0,066=0,014mol
Thanks