Hỗn hợp A gồm Al, Fe được chia thành 3 phần bằng nhau
PI + ddNaOH dư tạo ra 3,36 lít khí (đktc)
PII + H2SO4 loãng dư tạo 7,84 lít khí (đktc)
PIII + H2SO4 đặc đun nóng dư tạo ra SO2 là sản phẩm khử duy nhất
1. Viết các phương trình phản ứng. Tính V SO2 (đktc)
2. Tính số lít khí NO2 là sản phẩm khử duy nhất tạo ra nếu hòa tan toàn bộ hỗn hợp A vào axit HNO3 đặc, dư, nóng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phần 1:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2NaOH + 2Al + 2H2O --> 2NaAlO2 + 3H2
0,1<-----------------------0,15
=> nAl = 0,1 (mol)
Phần 2:
\(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,1---------------------------->0,15
Fe + H2SO4 --> FeSO4 + H2
0,2<-----------------------0,2
Phần 3:
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,1------------------------------->0,15
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2------------------------------>0,3
=> VSO2 = (0,15 + 0,3).22,4 = 10,08 (l)

Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Zn + H2SO4 (loãng) ---> ZnSO4 + H2
0,2<--------------------------------------0,2
Zn + 2H2SO4 (đặc) ---> ZnSO4 + SO2↑ + 2H2O
0,2--->0,4------------------------------->0,2
Cu + 2H2SO4 ---> CuSO4 + SO2↑ + 2H2O
0,2<--0,4<------------------------0,2
b, \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=0,2.64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{13+12,8}.100\%=50,4\%\\\%m_{Cu}=100\%-50,4\%=49,6\%\end{matrix}\right.\)
c, PTHH:
SO3 + H2O ---> H2SO4
0,4<---------------0,4
2SO2 + O2 --to, V2O5--> 2SO3
0,4<---------------------------0,4
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,2<--------------------------------------0,4
=> \(m_{FeS_2}=\dfrac{0,2.120}{100\%-20\%}=30\left(g\right)\)

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
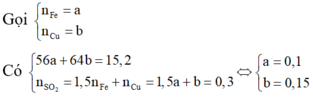
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g


1)
PI: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2NaOH + 2Al + 2H2O --> 2NaAlO2 + 3H2
0,1<-----------------------0,15
=> nAl = 0,1 (mol)
PII: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,1---------------------------->0,15
Fe + H2SO4 --> FeSO4 + H2
0,2<----------------------0,2
=> nFe = 0,2 (mol)
PIII:
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,1----------------------------->0,15
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2------------------------------->0,3
=> VSO2 = (0,15 + 0,3).22,4 = 10,08 (l)
2)
PTHH: Al + 6HNO3 --> Al(NO3)3 + 3NO2 + 3H2O
0,1--------------------------->0,3
Fe + 6HNO3 --> Fe(NO3)3 + 3NO2 + 3H2O
0,2---------------------------->0,6
=> VNO2 = (0,3 + 0,6).22,4 = 20,16 (l)