Đốt cháy m gam hỗn hợp gồm CH4, C2H2 và CxHy thu được 11 bam CO2 và 9 gam H2O. Tính m?
Các bạn giải thích cách làm giúp mình luôn nhé.
CẦN GẤP!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)=n_C\Rightarrow m_C=0,25.12=3\left(g\right)\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\Rightarrow n_H=1\left(mol\right)\Rightarrow m_H=1\left(g\right)\)
\(\Rightarrow m_{hh}=m_C+m_h=3+1=4\left(g\right)=m\)
nCO2=1144=0,25(mol)=nC⇒mC=0,25.12=3(g)nCO2=1144=0,25(mol)=nC⇒mC=0,25.12=3(g)
nH2O=918=0,5(mol)⇒nH=1(mol)⇒mH=1(g)nH2O=918=0,5(mol)⇒nH=1(mol)⇒mH=1(g)
⇒mhh=mC+mh=3+1=4(g)=m

nCO2=11\44=0,25(mol)=nC⇒mC=0,25.12=3(g)
nH2O=918=0,5(mol)⇒nH=1(mol)⇒mH=1(g)
⇒mhh=mC+mh=3+1=4(g)=m
nCO2=11/44=0,25(mol) => nC=0,25.1=0,25(mol) => mC=0,25.12=3(g)
nH2O=9/18=0,5(mol) => nH=0,5.2=1(mol) => mH=1.1=1(g)
theo định luật bảo toàn nguyên tố ta có:
m=mC+mH=3+1=4(g)

Ta có: \(n_{CO_2}=\dfrac{15,68}{22,4}=0,7\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\Rightarrow n_H=0,5.2=1\left(mol\right)\)
\(\Rightarrow m=m_C+m_H=0,7.12+1.1=9,4\left(g\right)\)

Đặt số mol các chất trong X lần lượt là a, b, c, d
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
\(CaC_2+2H_2O\rightarrow Ca\left(OH\right)_2+C_2H_2\)
\(Al_4C_3+12H_2O\rightarrow4Al\left(OH\right)_3+3CH_4\)
\(Ca\left(OH\right)_2+2Al+2H_2O\rightarrow Ca\left(AlO_2\right)_2+3H_2\)
\(Ca\left(OH\right)_2+2Al\left(OH_3\right)\rightarrow Ca\left(AlO_2\right)_2+4H_2O\)
Bảo toàn H: \(2n_{H_2Ođốt.cháy}=2n_{H_2}+2n_{C_2H_2}+4n_{CH_4}\)
\(\Rightarrow2b+12c+2d+3a=1,05mol\)
\(\Rightarrow2\left(b+d\right)+3\left(4c+a\right)=1,05=2n_{Ca}+3n_{Al}\)
( trong X nếu coi X gồm \(\left(Ca,Al,C\right)\)
\(m_X=40n_{Ca}+27n_{Al}+12n_C\left(n_C=n_{CO_2}=0,2mol\right)\)
\(\Rightarrow40n_{Ca}+27n_{Al}=12,75\left(g\right)\)
\(\Rightarrow n_{Ca}=0,15mol;n_{Al}=0,25mol\)
Sản phẩm không có kết tủa \(\Rightarrow\) dd gồm: \(Ca\left(AlO_2\right)_2\) và \(Ca\left(OH\right)_2\)
Bảo toàn ngtố \(\Rightarrow Y\) có: 0,125mol Ca(AlO2)2 và 0,025mol Ca(OH)2 , \(n_{HCl}=0,4mol\)
\(OH^-+H^+\rightarrow H_2O\)
Mol : \(0,05\rightarrow0,05\) \(\Rightarrow\) dư 0,35mol \(H^+\)
\(n_{H^+}=4n_{AlO_2}-3n_{Al\left(OH\right)_3}\)
\(\Rightarrow m_{Al\left(OH\right)_3}=78.\frac{0,65}{3}=16,9g\)

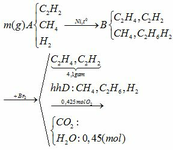
C2H2 + H2 C2H4
C2H2 + H2 C2H6
Khi cho hỗn hợp B qua dd nước Br2 chỉ có C2H4 và C2H2 phản ứng C2H2 +2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2
=> khối lượng bình Br2 tăng chính bằng khối lượng của C2H2 và C2H4
mC2H2 + mC2H4 = 4,1 (g)
Hỗn hợp khí D đi ra là CH4, C2H6 và H2
CH4 + 2O2 → t ∘ CO2 + 2H2O
C2H6 + O2 → t ∘ 2CO2 + 3H2O
2H2 + O2 → t ∘ 2H2O
Bảo toàn nguyên tố O cho quá trình đốt cháy hh D ta có:
2nCO2 = 2nO2 – nH2O => nCO2 = ( 0,425. 2– 0,45)/2 = 0,2 (mol)
Bảo toàn khối lượng : mhh D = mCO2 + mH2O – mO2 = 0,2.44 + 0,45.18 – 0,425.32 = 3,3 (g)
Bảo toàn khối lương: mA = (mC2H2 + mC2H4) + mhh D = 4,1 + 3,3 = 7,4 (g)

Đáp án : C
Vì nCO2 = nH2O nên n ankan = n ankin
=> nCH4 chiếm một nửa thể tích

Đáp án : C
Vì nCO2 = nH2O nên n ankan = n ankin
=> nCH4 chiếm một nửa thể tích
\(n_{CO_2}=\dfrac{11}{44}=0,25\left(mol\right)\)
=> nC = 0,25 (mol)
\(n_{H_2O}=\dfrac{9}{18}=0,5\left(mol\right)\)
=> nH = 1 (mol)
Do hỗn hợp chứa hidrocacbon
=> mhh = mC + mH = 12.0,25 + 1.1 = 4 (g)