Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Ta có: \(n_{Zn}=\dfrac{97,5}{65}=1,5\left(mol\right)=n_{H_2}\)
\(\Rightarrow V_{H_2}=1,5\cdot22,4=33,6\left(l\right)\)
c) Khử 120 gam gì vậy bạn ??
a) PTHH: Zn+2HCl→ZnCl2+H2↑Zn+2HCl→ZnCl2+H2↑
b) Ta có: nZn=97,565=1,5(mol)=nH2nZn=97,565=1,5(mol)=nH2
⇒VH2=1,5⋅22,4=33,6(l)
c) ???

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2--->0,3-------->0,1----------->0,3
b) `V_{H_2} = 0,3.22,4 = 6,72 (l)`
c) `m_{H_2SO_4} = 0,3.98 = 29,4 9g)`
d) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Xét tỉ lệ: 0,2 < 0,3 => H2 dư

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4----->0,2--->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
c)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,2----->0,2
=> mCu = 0,2.64 = 12,8 (g)

\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{40}{56\cdot2+16\cdot3}=0,25\left(mol\right)\\ PTHH:Fe_2O_3+3H_2-^{t^o}>2Fe+3H_2O\)
n(mol) 0,25->0,75-------->0,5---->0,75
\(m_{Fe}=n\cdot M=0,5\cdot56=28\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,75\cdot22,4=16,8\left(g\right)\)

nZn= 13/65=0,2(mol)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
b) nH2=nZnCl2=nZn=0,2(mol)
=>V(H2,đktc)=0,2 x 22,4= 4,48(l)
c) khối lượng muối sau phản ứng chứ nhỉ?
mZnCl2=136.0,2=27,2(g)

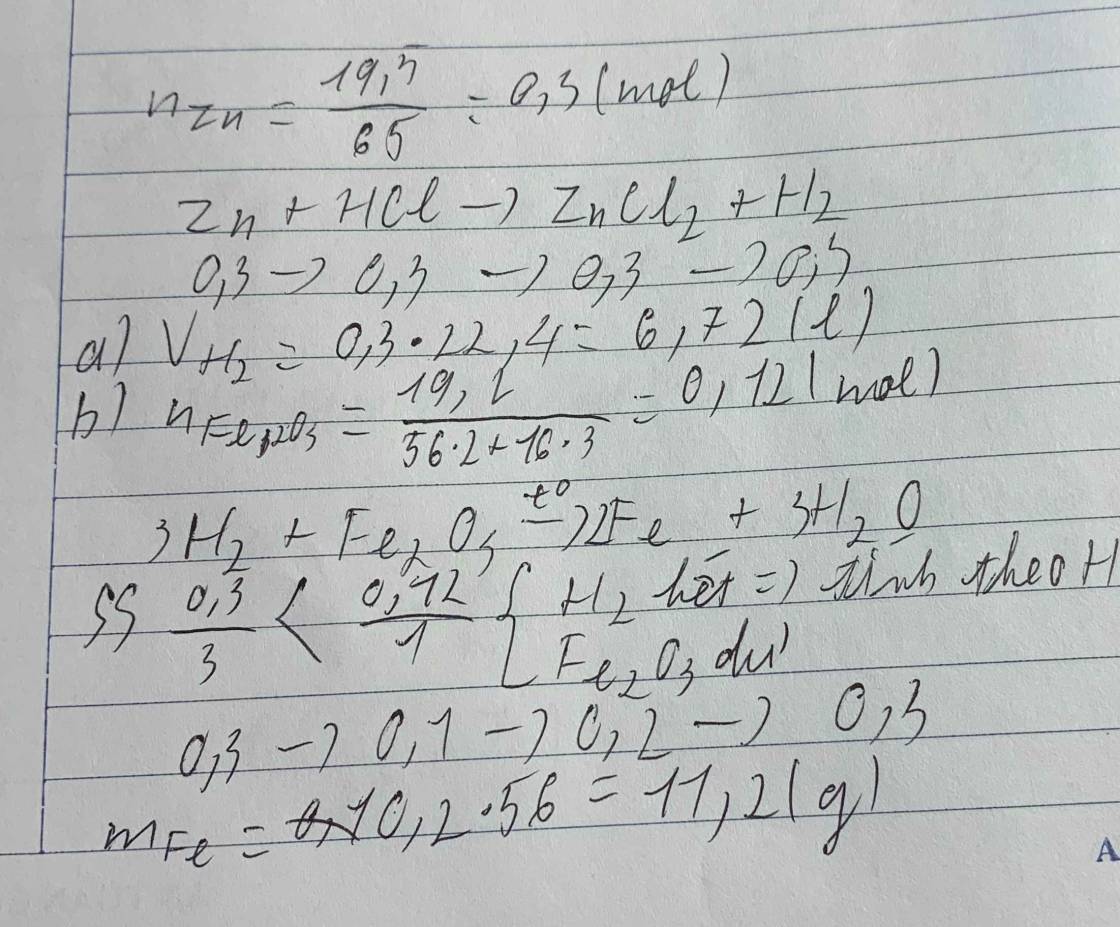
\(a) Zn + 2HCl \to ZnCl_2 + H_2\\ b) n_{H_2} = n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)\\ V_{H_2} = 0,1.22,4 = 2,24(lít)\\ c) n_{Fe_2O_3} = \dfrac{3,2}{160} = 0,02(mol)\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ 3n_{Fe_2O_3} = 0,02.3 = 0,06 < n_{H_2} = 0,1 \to H_2\ dư\)
Vậy lượng sắt III oxit trên phản ứng hết với lượng hidro sinh ra.
a) PTPƯ: Zn + 2 HCl → Zn\(_{ }Cl_2\) + \(_{_{ }}H_2\)
\(_{ }n_{Zn}\) = \(\dfrac{6,5}{65}\) = 0,1 ( mol)
Theo PTPƯ: để có 1 mol \(_{_{ }}H_2\) cần 1 mol Zn
⇒ có 0,1 mol Zn sẽ tạo ra 0,1 mol \(_{_{ }}H_2\)
\(_{ }V_{H_2}\) = n. 22,4 = 0,1 . 22,4 = 2,24 ( l)
c)
PTPƯ: 3 \(_{ }H_2\) + \(_{ }Fe_2O_3\) → 3 \(_{ }H_2O\) + 2Fe
tỉ lệ: 3 : 1 : 3 : 2
Số mol: 0,1 : \(\dfrac{1}{30}\)
\(_{ }m_{Fe_2O_3}\) = \(\dfrac{1}{30}\) . 160 = 5,3 ( g)