Câu 60: Cho một thanh sắt nặng 5,53g vào bình đựng dd axit clohiđric loang thu được dd A và khí bay lên. Cô cạn ddA được m (g) chất rắn. Hỏi dd A là gì và tìm m
A.FeCl2, m = 113,9825g B.FeCl2, m = 12,54125g
C.FeCl3,m = 55,3g D.Kô xác định được
Câu 61: Hợp chất nào sau đây không phải là oxit
A. CO2 B. SO2 C. CuO D. CuS
Câu 62: Oxit nào sau đây là oxit axit
A. CuO B. Na2O C. CO2 D. CaO
Câu 63: Oxit bắt buộc phải có nguyên tố
A. Oxi B. Halogen C. Hidro D. Lưu huỳnh
Câu 64: Chỉ ra những công thức viết sai: CaO, CuO, NaO, CO2, SO
CaO, CuO B. NaO, CaO C. NaO, SO D. CuO, SO
Câu 65: Chỉ ra các oxit bazo: P2O5, CaO, CuO, BaO, Na2O, P2O3
P2O5, CaO, CuO B.CaO,CuO,BaO,Na2O
C.BaO,Na2O,P2O3 D.P2O5,CaO,P2O3
Câu 66: Chỉ ra oxit axit: : P2O5, CaO, CuO, BaO, SO2, CO2
A.P2O5, CaO, CuO, BaO B. BaO,SO2,CO2
C.CaO,CuO,BaO D. SO2,CO2 ,P2O5
Câu 67: Chọn đáp án đúng
A.CO-cacbon (I) oxit B.CuO- đồng (II) oxit
C.FeO- sắt (III)oxit D.CaO- canxi trioxit
Câu 68: Axit tương ứng của CO2
A. H2SO4 B. H3PO4 C. H2CO3 D. HCl
Câu 69: Bazo tương ứng của MgO
A. Mg(OH)2 B. MgCl2 C. MgSO4 D. Mg(OH)3
Câu 70. Cho 10,8 g kim loại R(III) phản ứng vừa đủ với dd axit sunfuric loãng (H2SO4) .Sau phản ứng thu được 13,44 lít khí H2 (đktc) và dung dịch muối sunfat R2(SO4)3 R là kim loại nào sau đây
A. Al B. Fe C. Cr D. Sn


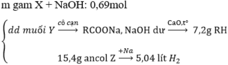

Câu 50: Sản phẩm rắn thu được sau khi nung hoàn toàn Chì (II) oxit trong Hiđro
A. Pb B. H2 C. PbO D. Không phản ứng
Câu 51: Để nhận biết hiđro ta dùng:
A. Que đóm đang cháy B. Oxi C. Fe D. Quỳ tím
Câu 52: Cho Al tác dụng tác dụng với H2SO4 loãng tạo ra mấy sản phẩm
A. 1 B. 2 C. 3 D. 4
Câu 53: Điều chế Hiđro trong công nghiệp, người ta dùng:
A. Cho Zn + HCl B. Fe + H2SO4 C. Điện phân nước D. Khí dầu hỏa
Câu 54: Sau phản ứng Zn và HCl trong phòng thí nghiệm, đưa que đóm đang cháy vào ống dẫn khí , khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
A. Đỏ B. Xanh nhạt C. Cam D. Tím
Câu 55: Chọn đáp án sai:
A. Kim loại dùng trong PTN phản ứng với HCl hoặc H2SO4 loãng là Cu
B. Hidro ít tan trong nước
C. CTHH của sắt là Fe D. Fe + 2HCl → FeCl2 + H2
Câu 56: Cho 6,5g Zn phản ứng với axit clohidric thấy có khí bay lên với thể tích là
A. 22,4 (l) B. 0,224 (l) C. 2,24 (l) D. 4,8 (l)
Câu 57: Chọn đáp án đúng:
A. PƯ giữa Fe và HCl là PƯ thế B.CaCO3 toàCaO +CO2 là PƯ hóa họp
C. PƯ thế là PƯ giữa hợp chất và hợp chất D.Khí H2 nặng hơn kô khí
Câu 58: Dd axit được dùng để điều chế hiđro trong PTN là:
A. H2SO4 đặc B. HCl đặc C. H2SO4 loãng D. A&B đều đúng
Câu 59: Tính khối lượng ban đầu của Al khi cho PƯ với axit sunfuric thấy có 1,68(l) khí thoát ra.
A. 2,025g B. 5,24g C. 6,075g D. 1,35g
Câu 60: Cho một thanh sắt nặng 5,53g vào bình đựng dung dịch axit clohidric loang thu được dung dịch A và khí bay lên. Cô cạn dung dịch A được m (g) chất rắn. Hỏi dung dịch A là gì và tìm m
A.FeCl2, m = 113,9825g B.FeCl2, m = 12,54125g
C.FeCl3,m = 55,3g D.Kô xác định được