Bài 1:Nhiệt phân 118,5 gam KMnO4 trong phòng thí nghiệm, thu được muối K2MnO4 ,MnO2 và khí oxi (O2).
a. Viết phương trình hóa học của phản ứng trên? Cho biết phản ứng trên thuộc loại phản ứng gì? Vì sao?
b. Tính thể tích khí O2 thu được ( ở đktc)?
c. Tính thể tích của không khí để chứa lượng oxi trên? Biết thể tích oxi bằng 1/5 lần thể tích không khí
( Biết: K = 39; O = 16; Mn = 55, S = 32)


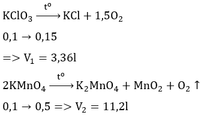
a. \(n_{KMnO_4}=\dfrac{118.5}{158}=0,75\left(mol\right)\)
PTHH : 2KMnO4 -----to----> K2MnO4 + MnO2 + O2
0,75 0,375
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,375.22,4=8,4\left(l\right)\)
c. \(V_{kk}=8,4.5=42\left(l\right)\)
a) 2KMn04 --> K2MnO4 + MnO2 + O2↑
PƯ này thuộc loại PƯ phân hủy
b) Có nKMnO4 = \(\dfrac{118.5}{39+55+16.4}\)=\(\dfrac{3}{4}\)=0,75
=> nO2 = 0,75x \(\dfrac{1}{2}\)=0,375
=> V của O2 là: 0,375 x 22,4=8,4(l)
c) Thể tích của ko khí là: 1/5 x 8,4=1,68(l)