Cho 16 gam CuO tác dụng với 2,24 lít khí H_{2} (đktc) ở nhiệt độ cao. Sau phản ứng thu được m gam chất rắn. a. Viết PTHH xảy ra. b. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2KMnO4-to>K2MnO4+MnO2+O2
0,14-------------0,07------0,07-------0,07 mol
n KMnO4=\(\dfrac{22,12}{158}\)=0,14 mol
=>a=mcr=0,07.197+0,07.87=23,82g
=>VO2=0,07.22,4=1,568l
b)
2Cu+O2-to>2CuO
0,07-----0,14
n Cu=\(\dfrac{10,24}{64}\)=0,16 mol
Cu dư :0,01 mol
m chất rắn =0,01.64+0,14.80=11,84g

a) 2KClO3 --to--> 2KCl + 3O2
b) \(n_{KClO_3}=\dfrac{36,75}{122,5}=0,3\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,3----------------->0,45
=> V = 0,45.22,4 = 10,08 (l)
nKClO3 = 36,75 : 122,5 = 0,3 (mol)
pthh : 2KClO3 -t--> 2KCl + 3O2
0,3----------------------->0,45 (mol)
=> V= VO2 = 0,45 . 22,4 = 10,08 (L)

a) \(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<-----------------------------0,5
=> \(m_{KMnO_4}=1.158=158\left(g\right)\)
b) \(n_{Fe_2O_3}=\dfrac{80}{160}=0,5\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,5--->1,5
=> \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,05<-0,05---->0,05-->0,05
=> \(n_{Cu\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
mCu = 0,05.64 = 3,2 (g)
VH2O = 0,05.22,4 = 1,12 (l)
a)\(n_{O_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1 0,5
\(M_{KMnO_4}=1\cdot158=158g\)
b)\(n_{Fe_2O_3}=\dfrac{80}{160}=0,5mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,5 1,5
\(V_{H_2}=1,15\cdot22,4=25,76l\)

a) Fe + H2SO4 --> FeSO4 + H2
b) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,1------------------------>0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
c) \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,1<--0,1------->0,1
=> mCuO(dư) = (0,15 - 0,1).80 = 4 (g)
mCu = 0,1.64 = 6,4 (g)
a, PT: \(Fe+H_2SO_4\rightarrow H_2SO_4+H_2\)
b, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{CuO\left(pư\right)}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow n_{CuO\left(dư\right)}=0,05\left(mol\right)\Rightarrow m_{CuO\left(dư\right)}=0,05.80=4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
Bạn tham khảo nhé!

Bài 1.
\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,1 0,1 0,1 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,15 0,1
\(\Rightarrow CuO\) dư và dư \(\left(0,15-0,1\right)\cdot80=4g\)
Bài 2.
\(n_P=\dfrac{3,1}{31}=0,1mol\)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,1 0,125
\(V_{O_2}=0,125\cdot22,4=2,8l\)
\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(2Zn+O_2\underrightarrow{t^o}2ZnO\)
0,3 0,125 0
0,25 0,125 0,25
0,05 0 0,25
\(\Rightarrow ZnO\) dư và dư \(0,05\cdot81=4,05g\)
Bài 1.
a, \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
Mol: 0,1 0,1
b, \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
Ta có: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\) ⇒ CuO dư, H2 hết
PTHH: CuO + H2 ---to----> Cu + H2O
Mol: 0,1 0,1
\(m_{CuOdư}=\left(0,15-0,1\right).80=4\left(g\right)\)

Ta có: \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BT e, có: x.nM = 4nO2 + 2nH2
\(\Rightarrow n_M=\dfrac{1,5}{x}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{13,5}{\dfrac{1,5}{x}}=9x\left(g/mol\right)\)
Với x = 3 thì MM = 27 (g/mol)
→ M là nhôm (Al)
m = mKL + mO2 = 13,5 + 0,3.32 = 23,1 (g)

Chọn A.
Rắn Z chứa Al dư (x mol), Al2O3 (y mol) và Fe với x = 2 3 n H 2 = 0 , 2 m o l → B T : A l y = 0 , 3
Khi cho Z tác dụng với HNO3 thì:
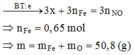
\(PTHH:CuO+H_2\rightarrow Cu+H_2O\)
\(n_{CuO}=\dfrac{m}{M}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\)
→ Sau phản ứng CuO dư, H2 hết
→ Theo \(n_{H_2}\)
Theo PTHH: \(n_{Cu}=n_{H_2}=0,1\left(mol\right)\)
⇒ Khối lượng Cu sinh ra là: \(m_{Cu}=0,1.64=6,4\left(g\right)\)
Khối lượng CuO phản ứng là: mCuO phản ứng\(=0,1.80=8\left(g\right)\)
Khối lượng CuO dư là:
mCuO dư = mCuO ban đầu – mCuO phản ứng \(=16-8=8\left(g\right)\)
Khối lượng chất rắn thu được sau phản ứng là:
mchất rắn = mCu sinh ra + mCuO dư \(=6,4+8=14,4\left(g\right)\)
nCuO = 16/80 = 0,2 (mol)
nH2 = 2,24/22,4 = 0,1 (mol)
PTHH: CuO + H2 -> (t°) Cu + H2O
LTL: 0,2 > 0,1 => CuO dư
nCuO (p/ư) = nCu = nH2 = 0,1 (mol)
=> m = (0,2 - 0,1) . 80 + 0,1 . 64 = 12,4 (g)