Cho dd chứa 7.4 g hidroxit vào 200ml dd HCL 1M thu được dd X chứa 11.37 gam chất tan .Kim loại tạo nên hidroxit là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử R hóa trị II
\(R(OH)_2\xrightarrow{t^o}RO+H_2O\\
4,9a.........4a(g)\)
Bảo toàn KL ta có: \(m_{H_2O}=0,9a\Rightarrow n_{H_2O}=0,05a(mol)\)
\(\Rightarrow M_{R(OH)_2}=\dfrac{4,9a}{0,05a}=98\\ \Rightarrow M_R=64(g/mol)(Cu)\)
Giả sử R hóa trị III
\(2R(OH)_3\xrightarrow{t^o}R_2O_3+3H_2O\\ 4,9a.........4a.......0,9a(g)\\ \Rightarrow n_{H_2O}=0,05a\Rightarrow n_{R(OH)_3}=\dfrac{1}{30}a(mol)\\ \Rightarrow M_{R(OH)_3}=\dfrac{4,9a}{\dfrac{1}{30}a}=147\\ \Rightarrow M_R=96(g/mol)(loại)\)
Sơ đồ p/ứ:
\(Cu(OH)_2\xrightarrow{H_2SO_4}CuSO_4+\begin{cases} Fe:x+y\\ Mg:z \end{cases}\rightarrow \begin{cases} Cu:y+z\\ Fe(dư):x\\ FeSO_4:y\\ MgSO_4:z \end{cases}\\\xrightarrow{NaOH}\begin{cases} Fe(OH)_2:y\\ Mg(OH)_2:z \end{cases}\xrightarrow{t^o}\begin{cases} Fe_2O_3:0,5y\\ MgO:z \end{cases}\)
Từ sơ đồ ta có hệ: \(\begin{cases} 56x+56y+24z=16\\ 56x+64y+64z=24,8\\ 80y+40z=16 \end{cases}\Rightarrow \begin{cases} x=0,1(mol)\\ y=0,1(mol)\\ z=0,2(mol) \end{cases}\)
\(\Rightarrow a=\dfrac{(64+17.2)(y+z)}{4,9}=6(g)\\ m_{Fe(A)}=(0,1+0,1).56=11,2(g)\\ m_{Mg}=0,2.24=4,8(g)\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{11,2}{16}.100\%=70\%\\ \%_{Mg}=100\%-70\%=30\% \end{cases}\)

Gọi số mol K là a
\(m_{KOH}=\dfrac{50.12}{100}=6\left(g\right)\)
PTHH: 2K + 2H2O --> 2KOH + H2
______a---------------->a------>0,5a
mKOH = 6 + 56a (g)
mdd (sau pư) = 39a + 50 - 2.0,5a = 50 + 38a (g)
=> \(\dfrac{6+56a}{50+38a}.100\%=15\%\)
=> a = 0,03 (mol)
=> x = 0,03.39 = 1,17(g)

Đáp án D
KOH + HCl → KCl + H2O
TH1: nHCl ≥ nKOH ⇒ Chất tan chỉ gồm KCl
nKCl = nKOH = 0,1
⇒ mKCl = 7,45 > m chất tan ⇒ loại
TH2: nHCl < nKOH
Đặt nHCl = a , nKOH dư = b ⇒ n KOH = n HCl + n KOH dư = a + b = 0,1 mol
n KCl = a mol
m chất tan = m KCl + m KOH dư = 74,5a + 56b = 6,525g
⇒ a = 0,05 mol; b = 0,05 mol
⇒ CM HCl = 0,5

Vì M thuộc nhóm IIA nên hidroxit và muối có công thức là \(M\left(OH\right)_2\) và\(MCl_2\)
\(M\left(OH\right)_2+2HCl\rightarrow MCl_2+H_2O\)
M+34 M+71
\(m_{tăng}=11.1-7.4=3.7\)
\(M_{tăng}=71-34=37\)
\(n_{tăng}=\dfrac{m}{M}=\dfrac{3.7}{37}=0.1\left(mol\right)\)
\(M_{M\left(OH\right)_2}=\dfrac{m}{M}=\dfrac{7.4}{0.1}=74\left(\dfrac{g}{mol}\right)\)
Mà \(M+2OH=74\)
\(\Rightarrow M=40\)
Vậy M là Ca.

M+HCL ---> MCl+1/2H2 (1)
0,4-> 0,4 ->0,2
Theo (1): nH2=1/2nHCl
mà nH2=0,25 mol > 1/2nHCl=0,4 mol
nên kim loại M còn phản ứng với nước tạo thêm H2.
M+H2O-->MOH+1/2H2 (2)
0,1 <- 0,05
Do đó sau phản ứng thu được dung dịch gồm 2 chất tan là MCl và MOH.
nH2(1)=1/2nHCl=0,4/2=0,2 mol
=>nH2(2)=0,25-0,2=0,05 mol
Theo (1,2): khối lượng chất tan=0,4(M+35,5)+0,1(M+17)=35,4g
=>0,5M=35,4-35,5*0,4-17*0,1=19,5
=>M=19,5/0,5=39(thỏa mãn)
Vậy M là K.

Gọi a, b lần lượt là số mol của Ca và M
25,7 gam hỗn hợp gồm; {Ca:a(mol)M:b(mol)
⇒40a+Mb=25,7(I)
Khi hòa tan hỗn hợp tren vào nước thì:
Ca(a)+2H2O−−−>Ca(OH)2(a)+H2(a) (1)
M(b)+2H2O−−−>M(OH)2(b)+H2(b) (2)
nH2(đktc)=8,9622,4=0,4(mol)
theo PTHH (1) và (2), ta có: a+b=0,4 (II)
Khi giữ nguyên lượng Ca và tăng gấp đôi lượng kim loại M rồi cho toàn bộ hỗn hợp này tác dụng hết với nước thì:
Ca(a)+2H2O−−−>Ca(OH)2(a)+H2(3)
M(2b)+2H2O−−−>M(OH)2(2b)+H2(4)
Theo đề, sau phản ứng thu được 56,4g hỗn hợp bazơ ở dạng khan
⇒74a+2b(M+34)=56,4
⇔74a+68b+2Mb=56,4(III)
Lấy (III)−2.(I)(III)−2.(I), ta được: −6a+68b=5 (IV)
Từ (III) và (IV), {a+b=0,4−6a+68b=5
⇔{a=0,3b=0,1
từ (I), ta có: 40a+Mb=25,7
⇔40.0,3+0,1.M=25,7
⇒M=137(Ba)
Vậy kim loại M hóa trị II cần tìm là Ba

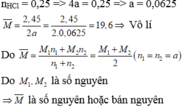
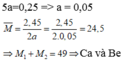
\(CT:M\left(OH\right)_n\)
\(M\left(OH\right)_n+nHCl\rightarrow MCl_n+nH_2O\)
\(M+17n...........M+35.5n\)
\(7.4..........................11.37\)
\(\Leftrightarrow11.37\left(M+17n\right)=7.4\left(M+35.5n\right)\)
\(\Leftrightarrow3.97M-69.41n=0\)
\(\Leftrightarrow M=17.48n\)
\(n=3\Rightarrow M=52\)
\(CT:Cr\left(crom\right)\)
Hình như chất tan chưa chắc nguyên muối âu...