hỗn hợp Al, Fe được chia thành 3 phần bằng nhau.
Phần 1+ dung dịch NaOH dư tạo ra 3,36 lít khí (Đktc)
Phần 2+ dung dịch H2SO4 loãng, dư tạo ra 7,84 lít khí (Đktc)
Phần 3+ H2SO4 đặc, nóng, dư tạo ra SO2 là sản phẩm khử duy nhất
Viết các Phương trình phản ứng, tính V của SO2 (Đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1)
PI: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2NaOH + 2Al + 2H2O --> 2NaAlO2 + 3H2
0,1<-----------------------0,15
=> nAl = 0,1 (mol)
PII: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,1---------------------------->0,15
Fe + H2SO4 --> FeSO4 + H2
0,2<----------------------0,2
=> nFe = 0,2 (mol)
PIII:
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,1----------------------------->0,15
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2------------------------------->0,3
=> VSO2 = (0,15 + 0,3).22,4 = 10,08 (l)
2)
PTHH: Al + 6HNO3 --> Al(NO3)3 + 3NO2 + 3H2O
0,1--------------------------->0,3
Fe + 6HNO3 --> Fe(NO3)3 + 3NO2 + 3H2O
0,2---------------------------->0,6
=> VNO2 = (0,3 + 0,6).22,4 = 20,16 (l)

1/2m hỗn hợp= 39,2
m muối tăng= mSO4-mCl
do nso4(2-)=1/2ncl-(bảo toàn điện tích hoặc có thể viết pt ra là thấy)
83,95-77,7=96.1/2.ncl-35,5ncl
ncl bị thay thế là 0,5
có ở phần 77,7. có btkluong 39,2+36,5.2.a=77.7+18a(a là n h20)
a=0,7 ----- tổng ncl = 1,4
n kloai là 77,7-1,4.35.5=28 ----- nfeo là x fe2o3 y (ở nửa phần) có 56x+112y=28......72x+160y=39,2
x=0,1 y=0,2
%feo=18,36...... fe203=81,64%
b, ncl còn lại=nhcl=1,4-0,5=0,9
nso4=1/2ncl=0.25=nh2so4
CM=(0,25+0,9)/0,5=2,3

\(\text{Mỗi phần,gọi :} n_{Al} = a ; n_{Fe} = b ; n_{Cu} = c\\ \Rightarrow 27a + 56b + 64c = \dfrac{35,8}{2} = 17,9(1)\\ \text{Phần 1 : Al,Fe không phản ứng với axit đặc nguội}\\ Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O\\ n_{Cu} = c = n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(2)\\ \text{Phần 2 : Cu không phản ứng với axit loãng}\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(3)\\ (1)(2)(3) \Rightarrow a = b = 0,1 ; c = 0,15\)
Suy ra :
\(m_{Al} = 0,1.2.27 = 5,4(gam)\\ m_{Fe} = 0,1.2.56 = 11,2(gam)\\ m_{Cu} = 0,15.64.2 = 19,2(gam)\)

Giải thích:
Chất rắn Y tác dụng với NaOH sinh ra H2 => Al dư => Chất rắn Y gồm: Al dư, Al2O3, Fe
nAl dư = nH2(P2)/1,5 = 0,0375/1,5 = 0,025 mol
nH2(P1) = nFe + 1,5nAl => nFe = 0,1375 – 1,5.0,025 = 0,1 mol
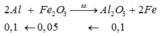
m(1 phần) = mAl ban đầu + mFe2O3 = 27(0,1+0,025) + 160.0,05 = 11,375 gam
=> m = 22,75 gam
Đáp án C

Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.
Phần 1:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2NaOH + 2Al + 2H2O --> 2NaAlO2 + 3H2
0,1<-----------------------0,15
=> nAl = 0,1 (mol)
Phần 2:
\(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,1---------------------------->0,15
Fe + H2SO4 --> FeSO4 + H2
0,2<-----------------------0,2
Phần 3:
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,1------------------------------->0,15
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,2------------------------------>0,3
=> VSO2 = (0,15 + 0,3).22,4 = 10,08 (l)