Hỗn hợp X gồm Zn, Al, Mg có khối lượng 22,1g được chia thành hai phần đều nhau. Đốt cháy hoàn toàn phần 1 trong khí oxi, sau phản ứng thu được 18,25g hỗn hợp chất rắn. Phần 2 đem hòa tan hết trong dung dịch axit sunfuric loãng, dư thoát ra V lít khí (đktc) và thu được dung dịch Y. Đun cạn dung dịch Y cho nước bay hét còn lại m gam chất rắn . tính V và m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\)(trong 1 phần)
- Phần 1:
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
_____x__________1/2x (mol)
\(2Zn+O_2\underrightarrow{t^o}2ZnO\)
y__________y (mol)
\(\Rightarrow\dfrac{1}{2}x.102+81y=26,4\left(1\right)\)
- Phần 2:
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
____x_________________________3/2x (mol)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
y_____________________y (mol)
Ta có: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(\Rightarrow\dfrac{3}{2}x+y=0,5\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{0,2.27+0,2.65}.100\%\approx29,35\%\\\%m_{Zn}\approx70,65\%\end{matrix}\right.\)
Bài 2: Có lẽ bài này đề yêu cầu tìm CTPT của A bạn nhỉ?
Đốt cháy A thu CO2 và H2O nên A chứa C và H, có thể có O.
Ta có: \(n_{CO_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{2,16}{18}=0,12\left(mol\right)\Rightarrow n_H=0,12.2=0,24\left(mol\right)\)
Ta có: mC + mH = 0,12.12 + 0,24.1 = 1,68 (g) < 3,6 (g)
→ A chứa C, H và O.
⇒ mO = 3,6 - 1,68 = 1,92 (g) \(\Rightarrow n_O=\dfrac{1,92}{16}=0,12\left(mol\right)\)
Gọi CTPT của A là CxHyOz.
\(\Rightarrow x:y:z=0,12:0,24:0,12=1:2:1\)
⇒ CTĐGN của A là (CH2O)n (n nguyên dương)
Ta có: \(n_{A\left(9\left(g\right)\right)}=n_{H_2}=\dfrac{0,1}{1}=0,1\left(mol\right)\Rightarrow M_A=\dfrac{9}{0,1}=90\left(g/mol\right)\)
\(\Rightarrow n=\dfrac{90}{12+2+16}=3\left(tm\right)\)
Vậy: CTPT của A là C3H6O3.

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

Gọi số mol Zn, Mg, Al trong mỗi phần là x, y, z (mol)
=> 65x + 24y + 27z = 7,15 (1)
- P1:
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
x--->2x------->x------>x
Mg + 2HCl --> MgCl2 + H2
y----->2y------->y---->y
2Al + 6HCl --> 2AlCl3 + 3H2
z---->3z-------->z------>1,5z
Theo PTHH: nHCl = 2.nH2 = 0,5 (mol)
a = mmuối = mkim loại + mCl = 7,15 + 0,5.35,5 = 24,9 (g)
Có: x + y + 1,5z = 0,25
- P2
PTHH: 2Zn + O2 --to--> 2ZnO
x---->0,5x
2Mg + O2 --to--> 2MgO
y--->0,5y
4Al + 3O2 --to--> 2Al2O3
z--->0,75z
=> \(n_{O_2}=\dfrac{1}{2}\left(x+y+1,5z\right)=\) 0,125 (mol)
b = moxit = mkim loại + mO2 = 7,15 + 0,125.32 = 11,15 (g)

Đáp án C:
Gọi x, y là số mol Mg và Fe trong mỗi phần
=> 24x+56y = 4,32
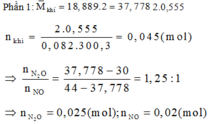

Phần 2: Gọi a, b lần lượt là số mol của AgNO3 và Cu(NO3)2
Sau phản ứng có 3 kim loại là Ag, Cu và Fe dư.
Gọi số mol Fe tham gia phản ứng là t (mol)
Bảo toàn electron ta có: nenhường= ne nhận
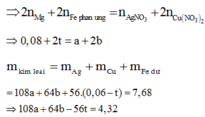
Chỉ có duy nhất Fe dư tan trong HCl
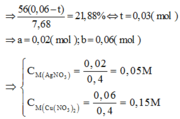

Gọi số mol Al, Fe2O3 mỗi phần lần lượt là a,b (mol) (a,b>0)
- Xét phần 2:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{H_2\left(P2\right)}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{Al\left(P2\right)}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{Al\left(P2\right)}=\dfrac{2}{15}.27=1,8\left(g\right)\\ m_{P2}=\dfrac{40,1}{2}=20,05\left(g\right)\\ \%m_{\dfrac{Al\left(P2\right)}{P_2}}=\%m_{\dfrac{Al}{2Phần}}=\dfrac{1,8}{20,05}.100\approx8,978\%\)
P1: Do chất rắn tác dụng với NaOH có khí thoát ra
=> trong Y chứa Al
P2: Gọi (nAl; nFe; nAl2O3) = (a;b;c)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a---------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = \(\dfrac{4,48}{22,4}=0,2\left(mol\right)\) (1)
mY = mX = 40,1
=> 54a + 112b + 204c = 40,1 (2)
PTHH: 2Al + Fe2O3 --to--> Al2O3 + 2Fe
=> \(\dfrac{n_{Fe}}{n_{Al_2O_3}}=\dfrac{2}{1}\) => \(\dfrac{b}{c}=\dfrac{2}{1}\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=\dfrac{9}{890}\left(mol\right)\\b=\dfrac{329}{1780}\left(mol\right)\\c=\dfrac{329}{3560}\left(mol\right)\end{matrix}\right.\)
=> nAl = 2.(a + 2c) = \(\dfrac{347}{890}\left(mol\right)\)
=> \(\%Al=\dfrac{27.\dfrac{347}{890}}{40,1}.100\%=26,252\%\)




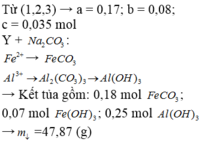
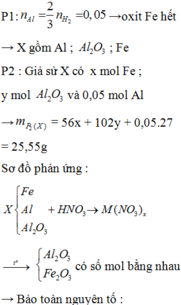
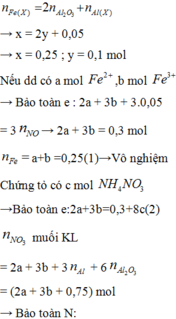
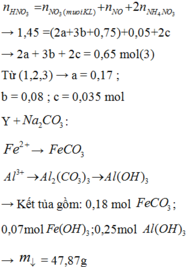
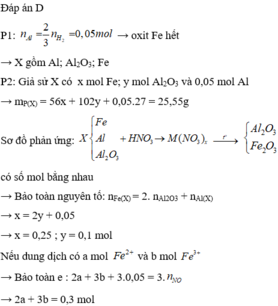

Ta có: m1 = m2 = 11,05 (g)
Phần 1:
PT: \(2Zn+O_2\underrightarrow{t^o}2ZnO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
Theo ĐLBT KL, có: mKL + mO2 = m oxit
⇒ mO2 = 18,25 - 11,05 = 7,2 (g)
\(\Rightarrow n_{O_2}=\dfrac{7,2}{32}=0,225\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Zn}+\dfrac{3}{4}n_{Al}+\dfrac{1}{2}n_{Mg}=0,225\left(mol\right)\)
\(\Rightarrow n_{Zn}+\dfrac{3}{2}n_{Al}+n_{Mg}=0,45\left(1\right)\)
Phần 2:
PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}+n_{Mg}\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_{H_2}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}=0,45\left(mol\right)\)
Theo ĐLBT KL, có: mKL + mH2SO4 = m muối + mH2
⇒ m chất rắn khan = m muối = 11,05 + 0,45.98 - 0,45.2 = 54,25 (g)
Bạn tham khảo nhé!