hỗn hợp X gồm H2 NH3 có tỉ khối so với Hidro bằng 5,5% khối lượng của khí NH3 trong hỗn hợp x là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Coi n X = 1(mol)
Gọi n H2 = a(mol) ; n N2 = b(mol)
Ta có :
a + b = 1
2a + 28b = 3,6.2 = 7,2
=> a = 0,8 ; b = 0,2
3H2 + N2 \(\xrightarrow{t^o,xt}\)2 NH3
3a........a..............2a........(mol)
Vì n H2 / 3 > n N2 / 1 nên hiệu suất tinh theo số mol N2
Gọi hiệu suất là a => n N2 pư = a(mol)
m Y = m X = 7,2
=> n Y = 7,2/(4,2826.2) = 0,84(mol)
Sau phản ứng, Y gồm :
H2 : 0,8 - 3a
N2 : 0,2 - a
NH3 : 2a
=> n Y = 0,8 - 3a + 0,2 -a + 2a = 0,84
=> a = 0,08 = 8%

Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
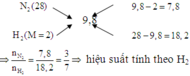
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
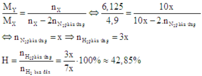
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng:
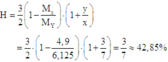

Gọi số mol của CO là \(a\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=2a\left(mol\right)=n_{NH_3}\\n_{O_2}=5,5a\left(mol\right)\end{matrix}\right.\)
Theo đề bài: \(a+2a+2a+5,5a=\dfrac{2,352}{22,4}=0,105\left(mol\right)\) \(\Rightarrow a=0,01\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,01}{0,105}\approx9,52\%\\\%V_{H_2}=\%V_{NH_3}=\dfrac{2\cdot0,01}{0,105}\approx19,05\%\\\%V_{O_2}=52,38\%\end{matrix}\right.\)
Mặt khác: \(\overline{M}_{khí}=\dfrac{0,01\cdot28+0,02\cdot2+0,02\cdot17+0,055\cdot32}{0,105}=23,05\) \(\Rightarrow d_{A/H_2}=\dfrac{23,05}{2}=11,525\)
*Phần tính % khối lượng bạn tự làm nhé, mình tính số mol ra rồi

Đáp án B.
Giả sử ban đầu hỗn hợp có 1 mol trong đó có x mol N2 và y mol H2
Ta có x + y =1 mol (1)

Đặt số mol N2 phản ứng là a mol
N2+ 3H2 → 2NH3
Ban đầu 0,2 0,8 mol
Phản ứng a 3a 2a mol
Sau pứ (0,2-a) (0,8-3a) 2a mol


Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)

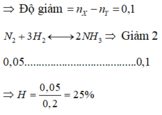
Gọi số mol H2, NH3 là a, b (mol)
\(M_X=\dfrac{2a+17b}{a+b}=5,5.2=11\left(g/mol\right)\)
=> 9a = 6b
=> a = \(\dfrac{2}{3}b\)
\(\%m_{NH_3}=\dfrac{17b}{2a+17b}.100\%=\dfrac{17b}{2.\dfrac{2}{3}b+17b}.100\%=92,7\%\)