hỗn hợp khí Y gồm khí metan và Khí Nitơ có tỉ khối so với H2 bằng 12,5% thể tích của khí metan thu được là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol CH4, O2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{16a+32b}{a+b}=14,4.2=28,8\left(g/mol\right)\)
=> 12,8a = 3,2b
=> a : b = 1 : 4
Giả sử A gồm 1 mol CH4 và 4 mol O2
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{4}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
1---->2----------->1
=> \(B\left\{{}\begin{matrix}CO_2:1\left(mol\right)\\O_{2\left(dư\right)}=4-2=2\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{1.44+2.32}{1+2}=36\left(g/mol\right)\)
=> \(d_{B/A}=\dfrac{36}{28,8}=1,25\)

Chọn C.
Đặt CTTQ của X là CxH4 Þ 12x + 4 = 28 Þ x = 2
Khi đốt cháy X thu được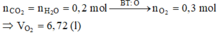

Hỗn hợp đầu có : V = 20 lít, M = 3.16 = 48
Áp dụng phương pháp đường chéo ta có :
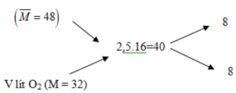
V O 2 = 20 lít

Gọi số mol CH4 ban đầu là 1 (mol), số mol phản ứng là a (mol)
PTHH: 2CH4--to, làm lạnh nhanh--> C2H2 + 3H2
Trc pư: 1 0 0
Pư: a--------------------------->0,5a--->1,5a
Sau pư: (1-a) 0,5a 1,5a
=> \(\Sigma n=\left(1-a\right)+0,5a+1,5a=1+a\left(mol\right)\)
\(m_X=m_{CH_4\left(bđ\right)}=1.16=16\left(g\right)\)
=> \(\overline{M}_X=\dfrac{16}{1+a}=5.2=10\)
=> a = 0,6 (mol)
=> \(H\%=\dfrac{0,6}{1}.100\%=60\%\)
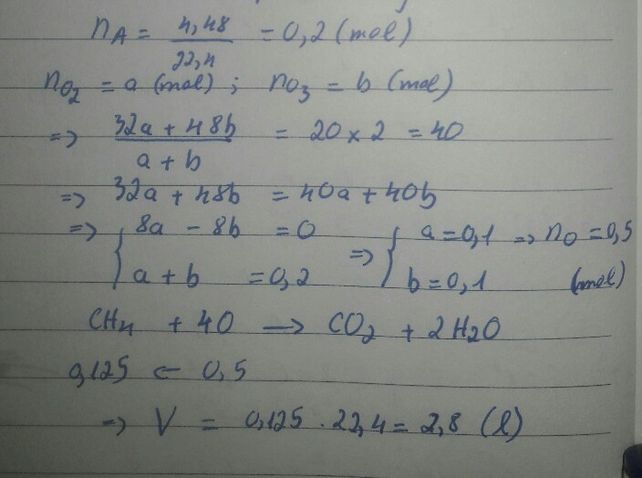

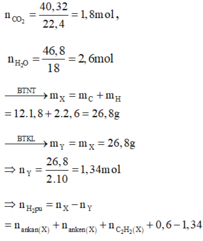

nY=1(mol)
nCH4=a(mol)
⇒nN2=1−a(mol)
M=\(\dfrac{\text{16 a + 28 ⋅ ( 1 − a )}}{1}\)=12.5=25(g/mol)
⇒a=0.25
%CH4=\(\dfrac{0,25}{1}\).100%=25%