Đốt cháy hoàn toàn 7,6 gam hỗn hợp Cu và Mg trong oxi ở nhiệt độ cao, thu được hỗn hợp 2 oxit trong đó 20% MgO. Hòa tan hỗn hợp này bằng dung dịch HCl 0,5M.
a. Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch HCl cần dùng để hòa tan hết các oxit ở trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Gọi số mol Cu, Mg là a, b (mol)
=> 64a + 24b = 7,6 (1)
PTHH: 2Cu + O2 --to--> 2CuO
a---------------->a
2Mg + O2 --to--> 2MgO
b------------------>b
=> \(\%MgO=\dfrac{40b}{80a+40b}.100\%=20\%\)
=> a = 2b (2)
(1)(2) => a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}m_{Cu}=0,1.64=6,4\left(g\right)\\m_{Mg}=0,05.24=1,2\left(g\right)\end{matrix}\right.\)
b)
PTHH: CuO + H2SO4 --> CuSO4 + H2O
0,1--->0,1
MgO + H2SO4 --> MgSO4 + H2O
0,05--->0,05
=> \(V_{ddH_2SO_4}=\dfrac{0,1+0,05}{0,5}=0,3\left(l\right)\)
Ủa anh ra khác em luôn...để anh xem lại

\(m_X = m_{kim\ loại} + m_{O}\\ \Rightarrow n_O = \dfrac{9,2-7,6}{16} = 0,1(mol)\\ n_{H_2} = \dfrac{0,672}{22,4} = 0,03(mol)\\ 2H^+ + 2e \to H_2\\ 2H^+ + O^{2-} \to H_2O\\ n_{H^+} = 2n_{H_2} + 2n_O = 0,1.2 + 0,03.2=0,26(mol)\\ n_{H_2SO_4} = \dfrac{1}{2}n_{H^+} = 0,13(mol)\\ \Rightarrow V = \dfrac{0,13}{0,5} = 0,26(lít)\)

Đáp án: A
mO(oxit) = moxit – m kim loại =22,3-15,1=7,2 gam
nO(oxit)=0,45 mol => nCl-= 2.0,45=0,9 mol
m muối= mkim loại+ mCl-= 15,1+0,9.35,3= 47,05 gam

Đáp án B
Chỉ xét kim loại trước H, nếu ko được, chọn Cu
Nhận xét: theo bảo toàn e: 2a + nb = 0,05.2 = 0,1
3a + mb = 0,045.4= 0,18 mol →như vậy m > 3 đoán ra Sn
56 a + 119 b = 4 , 69 a + b = 0 , 05 → a = 0 , 02 b = 0 , 03
%mM= 0,03.119/4,69 = 76,12%

Bài này ta hiểu là pứ đã hết CuSO4, và Cu tạo thành đã bám vào đinh, nên khối lượng chiếc đinh mới tăng, và Fe pứ đã tan vào dung dịch.
Gọi x là số mol fe đã pứ. x > 0
`
Fe + CuSO4 =-------------------> FeSO4 + Cu
x -------- x ----------------------------------------... x mol
`
Vậy KL tăng sau pứ là do hiệu giữa KL Cu bám vào và KL Fe đã tan ra. m = 0.8 = 64x - 56x
<=> x = 0.1 mol
KL Cu m= 64*0.1 = 6.4 g
KL Fe pứ: m = 56*0.1 5.6 g
Nồng độ mol dung dịch CuSO4 ban đầu: C = 0.1/0.2 = 0.5 M

\(n_{H_2}=\dfrac{0,953m}{22,4}=0,042545m\left(mol\right)\\ Đặt:n_{Mg}=x\left(mol\right);n_{Al}=y\left(mol\right);n_{Cu}=z\left(mol\right)\left(x,y,z>0\right)\\\Rightarrow \left\{{}\begin{matrix}24x+27y+64z=m\\40x+51y+80z=1,72m\\x+1,5y=0,042545m\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x\approx0,012845m\\y\approx0,0198m\\z\approx0,002455m\end{matrix}\right.\\ \Rightarrow\%m_{Cu}\approx\dfrac{0,002455.64m}{m}.100\%\approx15,712\%\\ \%m_{Al}\approx\dfrac{27.0,0198m}{m}.100\%\approx53,46\%\\ \%m_{Mg}\approx\dfrac{0,012845.24m}{m}.100\%\approx30,828\%\)

mO = 5,96 - 4,04 = 1,92 (g)
=> \(n_O=\dfrac{1,92}{16}=0,12\left(mol\right)\)
=> \(n_{H_2O}=0,12\left(mol\right)\)
=> \(n_{HCl}=0,24\left(mol\right)\)
=> \(V_{ddHCl}=\dfrac{0,24}{2}=0,12\left(l\right)\)

PTHH: Mg +2 HCl -> MgCl2 + H2
x_________2x_____x_______x(mol)
Zn + 2 HCl -> ZnCl2 + H2
y___2y_____y_______y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+65y=15,3\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{21}{205}\\y=\dfrac{81}{410}\end{matrix}\right.\)
=>mMg=21/205 . 24 = 504/205(g)
mZn=81/410 . 65=1053/82(g)
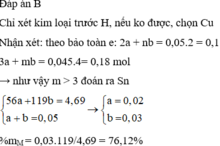
a/ Gọi x và y là số mol của Cu và Mg ban đầu.
Ta có: 64x + 24y = 7.6 g
<=> 8x + 3y = 0.95 (1)
2Cu + O2 ---------------> 2CuO
x ------------------------------ x mol
2Mg + O2 ---------------> 2MgO
y ------------------------------ y mol
Từ 2 ptpứ ta có KL hỗn hợp sau pứ là: m = 80x + 40y
Vì KL MgO chiếm 20% KL hỗn hợp nên:
\(\dfrac{40y}{80x+40y}\) = 20% = 0.2
<=> 40y = 0.2(80x + 40y)
<=> 40y = 16x + 8y
<=> 32y = 16x
<=> x = 2y. Thế vào (1) ta có:
<=>8.2y + 3y = 0.95
<=> 19y =0.95
<=> y = 0.05 mol.
===> x = 2.0.05 = 0.1 mol.
Vậy khối lượng Mg: m = 0.05.24 = 1.2 g
mCu: m = 7.6 - 1.2 = 6.4 g.
b/
2HCl `+ `CuO -------> CuCl2 + H2O
0.2 <--- 0.1 mol
2HCl ` + `MgO ------> MgCl2 + H2O
0.2 <----- 0.1 mol
Từ 2 pt trên ta tính lượng axit HCl nguyên chất cần dùng: n = 0.2 + 0.2 = 0.4 mol.
=>VHCl=\(\dfrac{0,4}{0,5}\)=0,8l=800ml