 khó hiểu quá
khó hiểu quá
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mới đầu mk cx thấy vậy nhưng lúc sau quen thui ko những còn giỏi đấy

Dùng pointer không phổ biến với cả không nên, vì Python được thiết kế để tránh những lỗi liên quan đến con trỏ như tràn bộ đệm và xung đột bộ nhớ. Nếu bạn muốn sử dụng con trỏ trong Python thì có thể dùng module ctypes để tương tác với các thư viện C. (Module cung cấp các kiểu dữ liệu và hàm để truy cập trực tiếp vào bộ nhớ, cho phép sử dụng con trỏ trong Python luôn). (nhớ dùng cẩn thận để tránh lỗi liên quan đến bộ nhớ:v)

x ∈ {năng lượng gió, năng lượng mặt trời, năng lượng địa nhiệt}
y ∈ {năng lượng gió, năng lượng mặt trời}

Rút gọn từ bên trên thôi em:
\(2x-3-x-5=x-8\)
\(2x-3+x+5=3x+2\)

a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right);n_{H_2SO_4}=0,1.2,5=0,25\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,2 0,2 0,2 0,2
Ta có: \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\) ⇒ Zn hết, H2SO4 dư
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c) \(m_{ZnSO_4}=0,2.161=32,2\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=\left(0,25-0,2\right).98=4,9\left(g\right)\)
Bài 2 :
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
100ml = 0,1l
\(n_{H2SO4}=2,5.0,1=0,25\left(mol\right)\)
a) Pt : \(Zn+2H_2SO_4\rightarrow ZnSO_4+H_2|\)
1 1 1 1
0,2 0,25 0,2 0,2
b) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,25}{2}\)
⇒ Zn phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Zn
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{ZnCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,25-0,2=0,05\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,05.98=4,9\left(g\right)\)
Chúc bạn học tốt


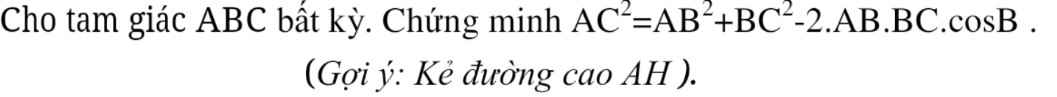
 ai đó giải thích tại sao : (x-8) (3x+2) với ạ khó hiểu quá
ai đó giải thích tại sao : (x-8) (3x+2) với ạ khó hiểu quá
khó thấy quá