Bài tập 1: Đốt cháy hoàn toàn 4,48 lit hỗn hợp gồm khí cacbon oxit và khí etilen, sau phản ứng thu được 1,8 g nước.
a) Tính thể tích mỗi khí trong hỗn hợp ban đầu.
b) Tính khối lượng khí cacbonic tạo thành sau phản ứng. biết thể tích các khí đo ở đktc.
Bài tập 2: Đốt cháy 4,48 lít etilen trong bình chứa 6,72 lít khí oxi. Hãy tính khối lượng các chất sau khi phản ứng kết thúc. Các thể tích khí đo ở đktc.



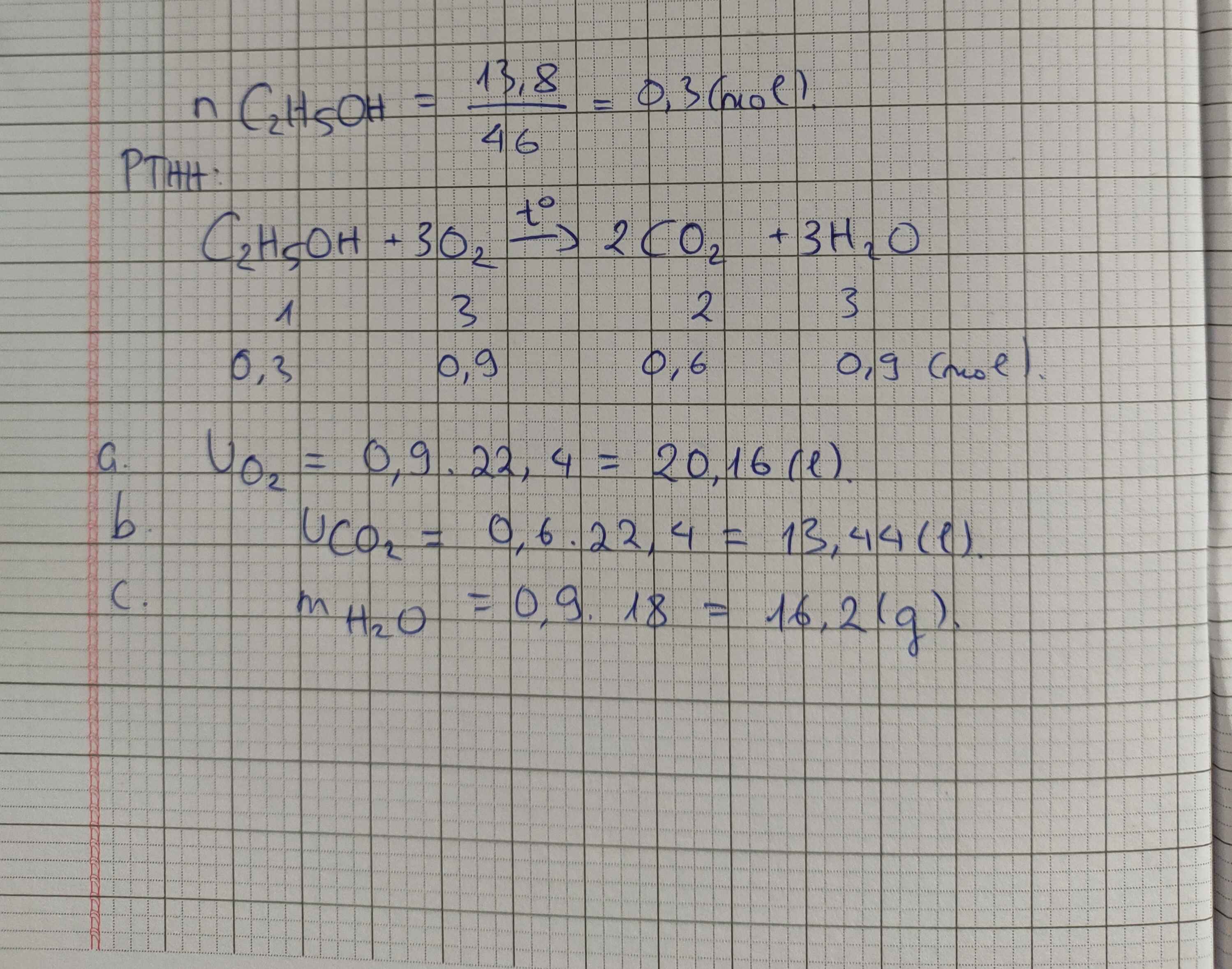
Bài 2.
\(n_{C_2H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
0,2 > 0,3 ( mol )
0,3 0,24 0,12 ( mol )
\(m_{CO_2}=0,24.44=10,56g\)
\(m_{H_2O}=0,12.18=2,16g\)
PTHH: 2CO + O2→2CO2
C2H4 + 3O2→ 2CO2 +2 H2O
nH2O= mM=\(\dfrac{1,8}{18}\)=0,1(mol)
nC2H4=\(\dfrac{1}{2}\).nH2O=\(\dfrac{1}{2}\).0,1=0,05(mol)
=> VC2H4=n.22,4=0,05.22,4=1,12(lít)
->VCO=4,48 − 1,12= 3,36(lít)
b) nCO2 (1)=nCO=\(\dfrac{3,36}{22,4}\)=0,15(mol)
mCO2 (1)=n.M=0,15.44=6,6(g)
nCO2 (2)=2.nC2H4=2.0,05=0,1(mol)
mCO2 (2)=n.M=0,1.44=4,4(g)
mCO2 sau pư=6,6 + 4,4= 11(g)