Oxi hoá chậm m gam Fe ngoài không khí thu được 12g hỗn hợp A gồm FeO, Fe2O3, Fe3O4 và Fe dư. Hoà tan hỗn hợp A vừa đủ bởi dung dịch HNO3 thu được 2,24 lít NO duy nhất (đktc). Khối lượng m gam Fe ban đầu là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Qui hỗn hợp về dạng:
Fe và O => mFe + mO = 12g (1)
nNO = 2,24: 22,4 = 0,1 mol
Bảo toàn e: 3nFe = 2nO + 3nNO => 3nFe – 2nO = 0,3 mol (2)
Từ (1,2) => nFe = 0,18 ; nO = 0,12 mol
=> nHNO3 = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64 mol
=> CM (HNO3) = 0,64: 0,2 = 3,2 M
m = mFe = 0,18.56 = 10,08g

O→ O {-2}
N{+5}→N{+2}
nFe=m/56
nO=(12-m)/16
nNO=0,1
Ta có:3nFe = 2nO + 3nNO
<=>3(m/56) = 2(12-m)/16 + 3*0,1
<=> m = 10,08
nHNO3 = 3*m/56 + nNO = 3*10,08/56 + 0,1 = 0,64(mol)
CM = 0,64/0,2 = 3,2 (M)
O→ O {-2}
N{+5}→N{+2}
nFe=m/56
nO=(12-m)/16
nNO=0,1
Ta có:3nFe = 2nO + 3nNO
<=>3(m/56) = 2(12-m)/16 + 3*0,1
<=> m = 10,08
nHNO3 = 3*m/56 + nNO = 3*10,08/56 + 0,1 = 0,64(mol)
CM = 0,64/0,2 = 3,2 (M)

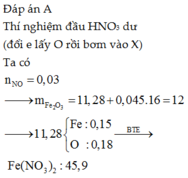
Bài này nếu là trắc nghiệm thì làm như sau:
Áp dung công thức kinh ngiệm: mFe=0,7mhh + 5,6 ne
Thay số vào thì được: m=0,7.12 + 5,6.2,24/22,4*3= 10,08 g
Nếu là tự luận thì làm theo bảo toàn e.
Fe .... -3e ---> Fe (3+)
m/56 3m/56
O2 .................. +4e ---> 2O (2-)
(12 - m)/32 ---> (12 - m)/8
N (+5) +3e ---> N (+2)
........... 0,3 <--- 0,1
Áp dụng định luật bảo toàn e: 3m/56 = (12-m)/8 + 0,3
Giải ra đc m = 10,08 g
Còn tính C M dd HNO3 thì làm chung theo cách sau:
Áp dụng ĐLBTNT Nitơ : n HNO3 = n NO + 3n Fe(NO3)3 = n NO + 3n Fe = 0,1 + 3*0,18 = 0,64
=> Cm dd HNO3 = 0,64/0,2 = 3,2 M
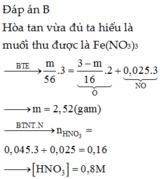
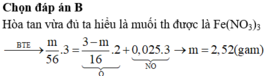


sử dụng phương pháp bảo toàn electron
‘-Các quá trình cho nhận electron:
Fe0 → Fe3+ + 3e
O20 +4e → 2O2-2
\(\dfrac{m}{56}->\dfrac{3m}{56}\dfrac{12-m}{32}->\dfrac{12-m}{8}\)
=> \(\dfrac{3m}{56}=\dfrac{12-m}{8}\) +0,3 => m = 10,08 (gam)