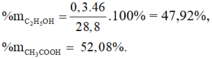cho 14,3g hh rượu etylic và axit axetic tác dụng vừa đủ với caco3
a.tính khối lượng mỗi chất trong hh đầu
b.nếu đun hh trên với h2so4 đặc thì sau phản ứng thu được bao nhiêu gam este,biết hiệu suất phản ứng đạt 80%
giúp mình với ạ ![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CH3COOH + NaOH $\to$ CH3COONa + H2O
n CH3COOH = n NaOH = 0,05(mol)
=> n C2H5OH = (7,6 - 0,05.60)/46 = 0,1(mol)
\(CH_3COOH + C_2H_5OH \buildrel{{H_2SO_4,t^o}}\over\rightleftharpoons CH_3COOC_2H_5 + H_2O\)
n CH3COOH = 0,05 < n C2H5OH = 0,1 nên hiệu suất tính theo số mol CH3COOH
n CH3COOC2H5 = n CH3COOH pư = 0,05.60% = 0,03 mol
=> m este = 0,03.88 = 2,64 gam

Gọi CTC ax: RCOOH
X: CH3OH và RCOOH
Gọi nCH3OH=a mol; nRCOOH=b mol
Đun nóng X các chất phản ứng vửa đủ với nhau => a=b
nH2=0,3 mol
=>Ta có a+b=0,6 mol
<=> a=b=0,3mol
Với H=100% => n este=0,3 mol=n ancol=n axit
M RCOOCH3=25/0,3
<=>R trung bình=73/3=24,33
Do R no,đồng đẳng kế tiếp => R1=15 và R2=29
=>2 axit là CH3COOH và C2H5COOH
cho mình hỏi là nH2=0.3 là của cả nH2(ancol) và nH2(axit) mà đúng không? vậy thì a=b=0.15 chứ nhỉ. nếu mình làm vậy thì nó lại không ra kq, vậy rốt cuộc tại sao có thể kết luận 0.3 đề cho không phải là tồng nH2?

n H2 =0,3 mol
n NaOH =0,2 mol
=>n OH= n H+ =0,2 mol
=>n CH3COOH=0,2 mol
=>m CH3COOH=0,2.60=12g
->n C2H5OH=0,1 mol
=>m C2H5OH=4,6g
=>mC2H5OH=\(\dfrac{4,6}{4,6+12}100=27,71\%\)
=>maxit=72,29%
b)
CH3COOH+C2H5OH->CH3COOC2H5+H2O
0,1-------------0,1
=>H=82%
=>m CH3COOC2H5=0,082.88=7,216g

Đáp án B
Gọi số mol của C2H5OH và CH3COOH lần lượt là x, y
Ta có hệ 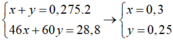
CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
Vì nCH3COOH > nC2H5OH nên hiệu suất được tính theo axit
Có neste = 0,2 mol → H = 0,2/0,25.100% = 80%