Hòa tan 120g KCl vào 250g nước ở 50°C.Tính lượng muối còn thừa sau khi tạo thành dung dịch bão hòa.Biết độ tan của KCl ở 50°C là 42,6g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


S=mKCl/mH2O.100=42,6(g)
=> mKCI (tan)=106,5(g)
=> mKCI ( thừa ) - 13,5 (g)

Ở 50oC có:
Cứ 100g nước hòa tan tối đa 42,6 g KCl
Cứ 250g nước hòa tan tối đa x g KCl
=> x =250.42,6100 = 106,5 g
Lượng muối còn thừa sau khi tạo thành dd bão hòa là:
muối còn thừa = 250 - 106,5 = 143,5 (g)
Bạn tham khảo ^^

\(m_{KClO_3\left(tan\right)}=42,6.\dfrac{250}{100}=106,5\left(g\right)\\ m_{KClO_3\left(thừa\right)}=120-106,5=13,5\left(g\right)\)

Bài giải:
Ở 50oC, 100g nước hòa tan 42,6g KCl tạo 142,6g dung dịch bão hòa
Ở 50oC, 250g nước hòa tan ? gam KCl tạo 142,6g dung dịch bão hòa
Khối lượng KCl tối đa tan trong 250g nước:
\(\dfrac{250}{42,6}.100=106,5\) (g)
Vậy khi cho 120g KCl vào 250g nước thì tạo thành dung dịch bão hòa
Khối lượng KCl không tan là:
120-106,5 = 13,5 (g)

Ở 80oC, 100 gam nước hòa tan 51 gam KCl tạo ra 151 gam dd KCl bão hòa
=> 400 gam nước hòa tan 204 gam KCl tạo ra 604 gam dd KCl bão hòa
Gọi n là số mol muối KCl kết tinh (n>0)
=> mKCl (kt)= 74,5n (g)
Ở 20oC
\(34=\dfrac{204-74,5n}{400}\times100\)
=> \(n\approx0,9128\left(mol\right)\)
=> mKCl (kt)= 0,9128\(\times\)74,5= 68,0036 (g)

Ta có:\(S_{50C}\)=42,6g=>
Ở 50 độ C,100g nước hòa tan tối đa 42,6g KCl
.................250g...................................x(g) KCl
=>Khối lượng KCl tan trong 250g nước tạo thành dd bão hòa là:
\(m_{KCl\left(tan\right)}\)=x=\(\dfrac{250}{100}\).42,6=106.5g
=>khối lượng muối còn thừa là:
\(m_{KCl\left(dư\right)}\)=120-106,5=13,5g

\(\dfrac{S}{S+100}=\dfrac{m_{ct}}{m_{bãohòa}}\Rightarrow\dfrac{35,9}{35,9+100}=\dfrac{m_{ct}}{5\cdot1000}\)
\(\Rightarrow m_{ct}=1320,824g=1,32kg\)

Bài này có 2 phần phần b bị dính vô phần a mọi người thông cảm giúp
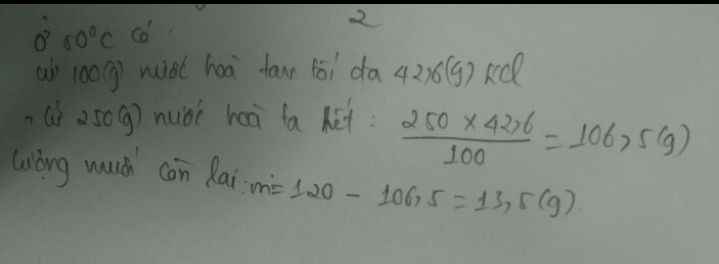
Có: \(S=\dfrac{m_{KCl}}{m_{H_2O}}.100=42,6\left(g\right)\)
=> mKCl(tan) = 106,5 (g)
=> mKCl(thừa) = 120 - 106,5 = 13,5 (g)