Đốt cháy hoàn toàn Phosphorus trong bình chứa 2,479 lit Oxygen (đkc) thu được hơp chất có công thức P2O5. Tính khối lượng sản phẩm thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
_____0,4____0,5_____0,2 (mol)
a, \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
b, \(V_{O_2}=0,5.22,4=11,2\left(l\right)\)

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,2\left(mol\right)\Rightarrow m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
c, \(n_{O_2}=\dfrac{5}{4}n_P=0,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,5.22,4=11,2\left(l\right)\)
d, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=\dfrac{1}{3}\left(mol\right)\Rightarrow m_{KClO_3}=\dfrac{1}{3}.122,5=\dfrac{245}{6}\left(g\right)\)

\(Đăt:n_{CO_2}=a\left(mol\right),n_{H_2O}=b\left(mol\right)\)
\(BTNTO:\\ 2n_{O_2}=2n_{CO_2}+n_{H_2O}\\ \Leftrightarrow2a+b=0.75\left(1\right)\)
\(m_{bìnhgiảm}=m_{CaCO_3}-\left(m_{CO_2}+m_{H_2O}\right)=21\left(g\right)\)
\(\Leftrightarrow44a+18b=60-21=39\left(g\right)\left(2\right)\)
Bạn xem lại đề nha
\(n_{CO_2} = n_{CaCO_3} = 0,6(mol)\)
\(m_{tăng} = n_{CO_2} + m_{H_2O} - m_{CaCO_3}\\ \Rightarrow n_{H_2O} = \dfrac{60-21-0,6.44}{18} = 0,7(mol)\)
\(n_{N_2} = n_{khí\ thoát\ ra} = 0,1(mol)\)
\(n_{O_2} =0,75(mol)\)
BTNT với C,H,O và N :
\(n_C = n_{CO_2} = 0,6\\ n_H = 2n_{H_2O} = 0,7.2 = 1,4(mol)\\ n_N = 2n_{N_2} = 0,2(mol)\\ n_O = 2n_{CO_2} + n_{H_2O} -2n_{O_2}= 0,4(mol)\)
Ta có :
\(n_C : n_H : n_O : n_N = 0,6 : 1,4 : 0,4 : 0,2 = 3 : 7 :2 : 1\)
Vậy CTPT của Y :C3H7O2N

a. \(n_{KMnO_4}=\dfrac{47.4}{158}=0,3\left(mol\right)\)
PTHH : 2KMnO4 ---to----> K2MnO4 + MnO2 + O2
0,3 0,15
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b. PTHH : 4Al + 3O2 -> 2Al2O3
0,2 0,15
\(m_{Al}=0,2.27=5,4\left(g\right)\)
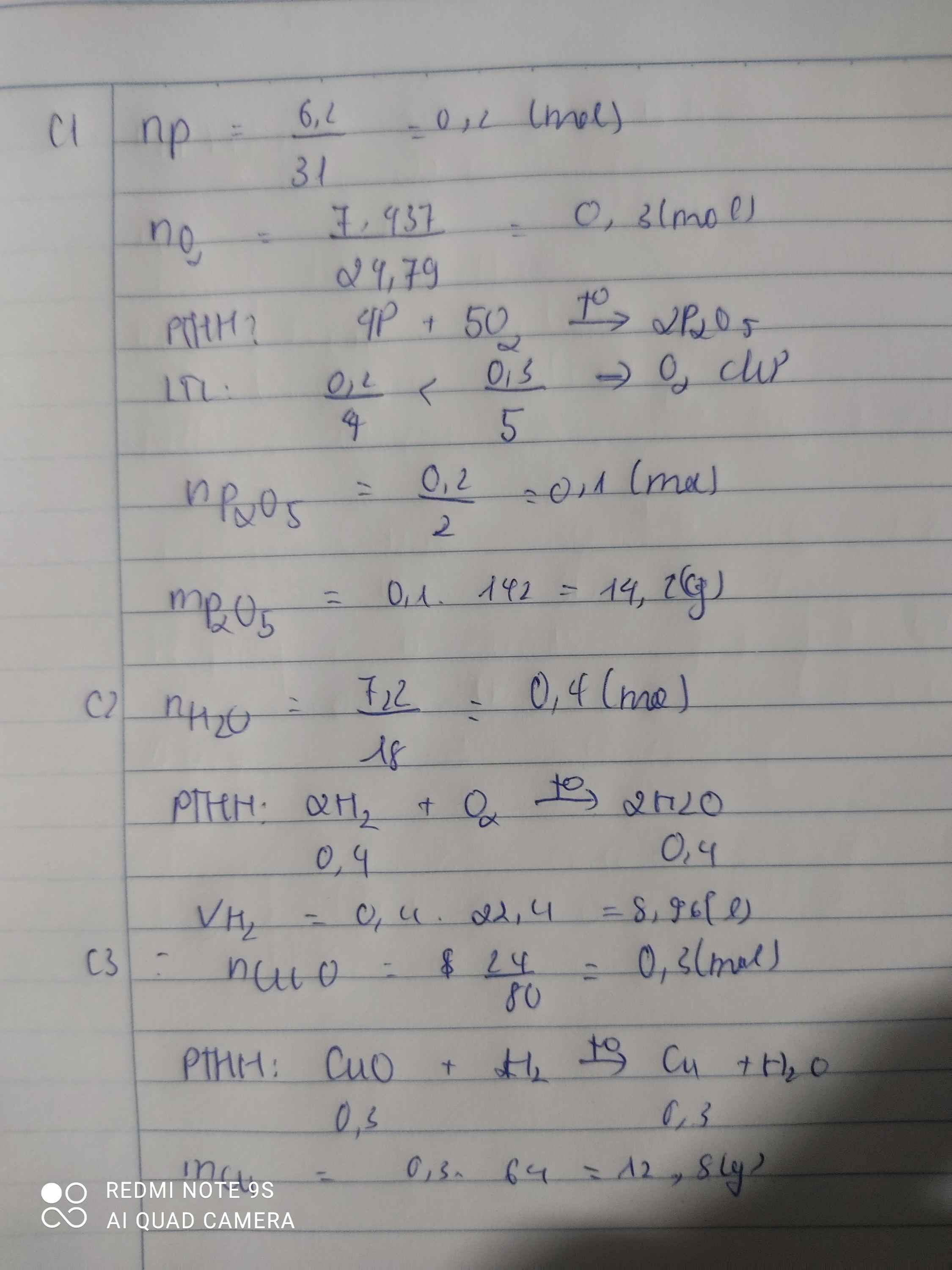
nO2 = 2,479/24,79 = 0,1 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 <--- 0,1 ---> 0,04
mP2O5 = 0,05 . 142 = 5,68 (g)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(nO_2=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(\Rightarrow nP_2O_5=\dfrac{2}{5}.nO_2=\dfrac{2}{5}.0,1=0,04\left(mol\right)\)
\(mP_2O_5=0,04.142=5,68\left(g\right)\)