viết phương trình hoá học điều chế hidro trong phòng thí nghiệm từ các kim loại Mg,Fe,Al và axit a) axit clohidric. b) axit sunfuric loãng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


![]()
Để điều chế 0,05 mol H 2 thì:
n Z n = n M g = 0,05 mol mà M M g < M Z n
⇒ Dùng Mg sẽ cần khối lượng nhỏ hơn
n H C l = 2 . n H 2 = 0,05 . 2 = 0,1 mol ⇒ m H C l = 0,1 . 36,5 = 3,65 g
n H 2 S O 4 = n H 2 = 0,05 mol ⇒ m H 2 S O 4 = 0,05 .98 = 4,9g
⇒ Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H 2 ta dùng Mg và axit HCl

A + O2 \(\underrightarrow{t^o}\) A2On (Trường hợp này ko dành cho Fe3O4 nhé)
A + nH2O \(\rightarrow\) A(OH)n + \(\dfrac{1}{2}n\)H2 (Cái này có khi và chỉ khi A là kim loại kiềm hoặc kiềm thổ)
2A + 2nHCl \(\rightarrow\) 2ACln + nH2 (Trường hợp này ko dành cho Fe3O4 nhé)
2A + nH2SO4 \(\rightarrow\) A2(SO4)n + nH2 (Trường hợp này ko dành cho Fe3O4 nhé)
2A + 2nH2SO4 (đ) \(\underrightarrow{t^o}\) A2(SO4)n + nSO2 + 2nH2O
bạn có cần giải thích rõ hơn vì sao các pt này ko dành cho Fe3O4 không?

\(Zn + 2HCl \to ZnCl_2 + H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{Fe} = n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ m_{Fe} = 0,1.56 = 5,6(gam) ; m_{Zn} = 0,1.65 = 6,5(gam)\)

a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 (loãng) → FeSO4 + H2
Zn + H2SO4 → ZnSO4 + H2
Fe + 2HCl → FeCl2 + H2
b. Số mol khí hiđro là: n = 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1x65 = 6,5 (g)
Khối lượng sắt cần dùng là: m = 0,1x56 = 5,6 (g).
Phan Thùy Linh tại sao lại số mol của H2 bằng 0,1 (vậy số liệu 2,24 l đang ở đâu, làm sao có kết quả này).
Khi viết m, viết n em có biết khối lượng của cái gì hay là số mol của cái gì đâu. dù đã dẫn ở lời giải nhưng vẫn phải viết chứ.
Đối với những phản ứng điều chế khí thì khí thường bay hơi nên phải có chiều mũi tên đi lên nhé.
Đối với phản ứng số (3) thì Zn chỉ phản ứng được với "H2SO4 (loãng)" thôi.

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
- Nếu dùng HCl: nHCl = 2.nH2 = 0,1 (mol)
=> mHCl = 0,1.36,5 = 3,65 (g)
- Nếu dùng H2SO4: nH2SO4 = nH2 = 0,05 (mol)
=> mH2SO4 = 0,05.98 = 4,9 (g)
=> Dùng HCl để cần khối lượng nhỏ nhất
=> 1 trong 2 đáp án A, C đúng
- Nếu dùng Fe
PTHH: Fe + 2HCl --> FeCl2 + H2
0,05<-0,1
=> mFe = 0,05.56 = 2,8 (g)
- Nếu dùng Mg
PTHH: Mg + 2HCl --> MgCl2 + H2
0,05<--0,1
=> mMg = 0,05.24 = 1,2 (g)
=> Dùng Mg để có khối lượng nhỏ nhất
=> Chọn C

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
Mg + 2HCl ---> MgCl2 + H2
Zn + 2HCl ---> ZnCl2 + H2
Fe + 2HCl ---> FeCl2 + H2
Mg + H2SO4 ---> MgSO4 + H2
Zn + H2SO4 ---> ZnSO4 + H2
Fe + H2SO4 ---> FeSO4 + H2
Theo các pthh trên: \(\left\{{}\begin{matrix}n_{HCl}=2n_{H_2}=2.0,1=0,2\left(mol\right)\\n_{H_2SO_4}=n_{H_2}=0,1\left(mol\right)\\n_{Fe}=n_{Zn}=n_{Mg}=n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\left\{{}\begin{matrix}m_{HCl}=0,2.36,5=7,3\left(g\right)\\m_{H_2SO_4}=98.0,1=9,8\left(g\right)\end{matrix}\right.\\\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_{Zn}=0,1.65=6,5\left(g\right)\\m_{Mg}=0,1.24=2,4\left(g\right)\end{matrix}\right.\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}m_{HCl}< m_{H_2SO_4}\\m_{Mg}< m_{Fe}< m_{Zn}\end{matrix}\right.\)
Vậy chọn HCl và Mg thì đièu chế vs lượng nhỏ nhất
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
Nếu dùng HCl:
\(n_{HCl}=2n_{H_2}=0,2mol\Rightarrow m_{HCl}=0,2\cdot36,5=7,3g\)
Nếu dùng \(H_2SO_4\) :
\(n_{H_2SO_4}=n_{H_2}=0,1mol\Rightarrow m_{H_2SO_4}=0,1\cdot98=9,8g\)
\(\Rightarrow\)Dùng \(HCl\) để cần một khối lượng nhỏ nhất.
Nếu dùng Mg:
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 0,1
\(m_{Mg}=0,1\cdot24=2,4g\)
Nếu dùng Zn:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,1
\(m_{Zn}=0,1\cdot65=6,5g\)
Nếu dùng Fe:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,1
\(m_{Fe}=0,1\cdot56=5,6g\)
\(\Rightarrow\)Dùng Mg để có khối lượng nhỏ nhất.
Vậy dùng kim loại Mg và axit HCl.
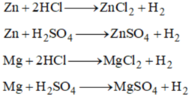

a.
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b.
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Thêm đk H2SO4 loãng chứ đặc nóng có thể giải phóng H2S, SO2,...