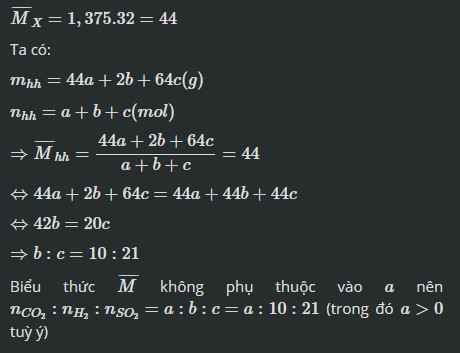
Hỗn hợp X chứa a mol CO2, b mol H2, c mol SO2. Hỏi a, b, c phải có tỉ lệ như thế nào để tỉ khối của X so với khí oxi bằng 1,375.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

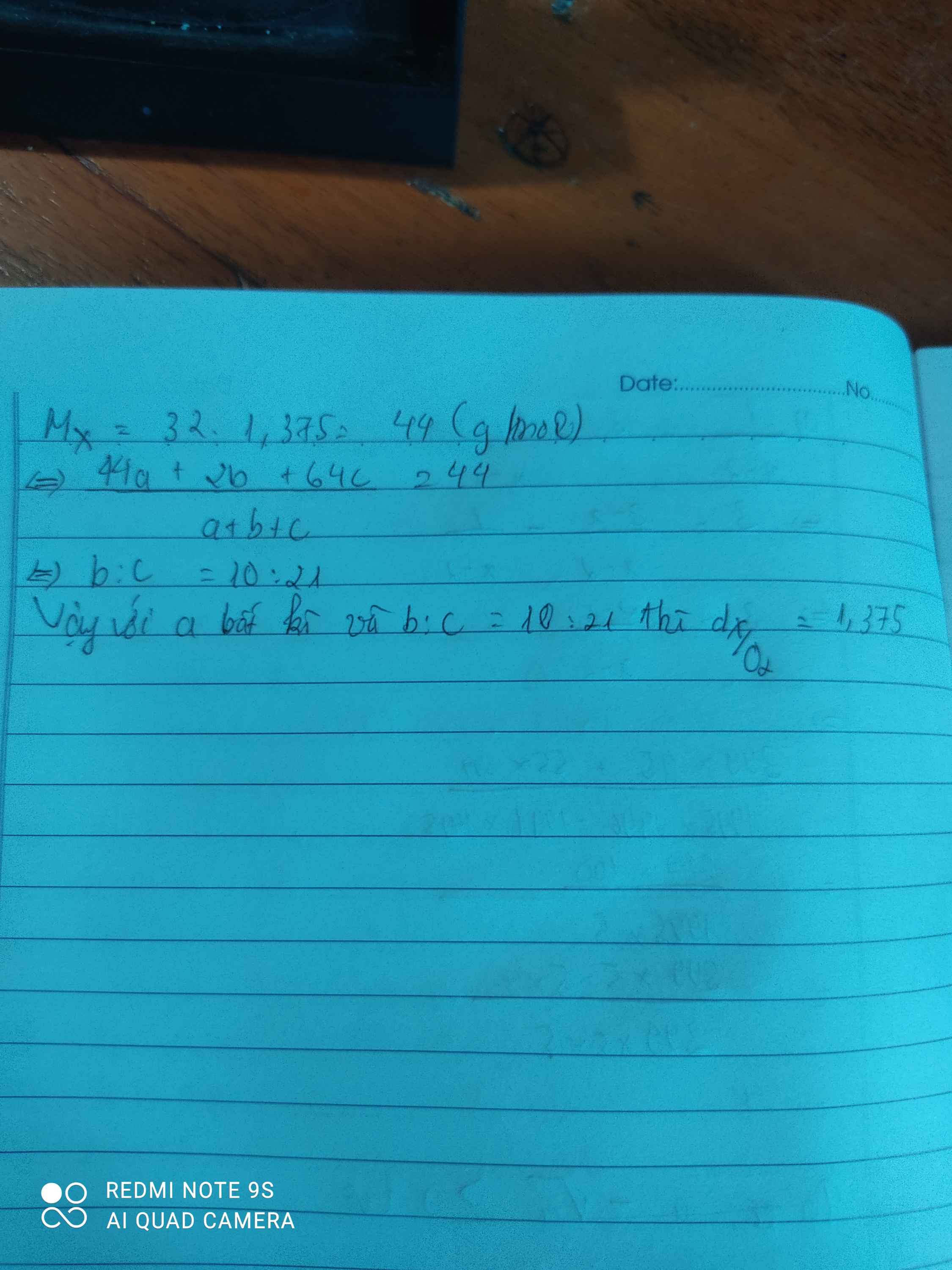

\(Mx=\)44g/mol
-> \(\frac{44a+2b+64c}{a+b+c}=44\)
-->\(b:c=10:21\)
Vậy với a bất kì và \(b:c=10:21\) thì tỉ khối của X so với khí oxi bằng 1,375
Tại sao lại vs bất kì a và b:c=10:21 thì tỉ khối của X so vs khí oxi bằng 1,375.

\(\overline{M_{hh}}\) = 1,375x 32 = 44 (g/mol)
=>\(\dfrac{44a+2b+64c}{a+b+c}\) = 44
=> 44a + 2b + 64c = 44a + 44b + 44c
=> 2b + 64c = 44b +44c
=> 42b = 20c
=> b:c = 20: 42 = 10: 21
Vì MCO2 = 44 (g/mol)
=> Tỉ khối của X chỉ phụ thuộc vào tỉ lệ mol của H2 và SO2
=> a:b:c = a: 10: 21

:) làm thế này thì còn gì môn khtn nữa, mình ko làm được thì để người khác làm

a, mX = 0,2.32 + 0,15.28 = 10,6 (g)
nX = 0,2 + 0,15 = 0,35 (mol)
=> MX = \(\dfrac{10,6}{0,35}=30,3\left(\dfrac{g}{mol}\right)\)
=> dX/kk = \(\dfrac{30,3}{29}=1,05\)
b, mY = 0,5.44 + 2.2 = 26 (g)
nY = 0,5 + 2 = 2,5 (mol)
=> MY = \(\dfrac{26}{2,5}=10,4\left(\dfrac{g}{mol}\right)\)
=> dY/O2 = \(\dfrac{10,4}{32}=0,325\)
c, mA = 17,75 + 8,4 = 26,15 (g)
nA = \(\dfrac{17,75}{71}+\dfrac{8,4}{28}=0,55\left(mol\right)\)
=> MA = \(\dfrac{26,15}{0,55}=47,6\left(\dfrac{g}{mol}\right)\)
=> dA/CO2 = \(\dfrac{47,6}{44}=1,1\)
Mình làm mẫu 3 ý đầu rồi mấy ý sau bạn tự làm nhé

Gọi số mol của CO là a, của SO2, CO2 là b
Có: \(\dfrac{28a+44b+64b}{a+2b}=20,5.2=41\)
=> a = 2b
=> \(\left\{{}\begin{matrix}\%CO=\dfrac{a}{a+2b}.100\%=50\%\\\%SO_2=\%CO_2=\dfrac{b}{a+2b}.100\%=25\%\end{matrix}\right.\)