điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60% làm bằng 2 cách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

điều chế oxi bằng cách nung 24,5g KCLO3 tính lượng oxi thu được ,biết hiệu suất phản ứng chỉ đạt 60%

Số mol KClO3 là:
\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
PTHH
\(2KClO_3\rightarrow2KCl+3O_2\)
0,2 mol.....................0,3mol
lượng oxi thu dc trên lý thuyết là:
\(m_{O_2}=0,3.32=9.6\left(g\right)\)
Lượng oxi thu dc thực tế là:
\(m_{O_2thucte}=9,6.60\%=5,76\left(g\right)\)

Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)

Ta có: \(n_{KClO_3}=\dfrac{19,6}{122,5}=0,16\left(mol\right)\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
____0,16___________0,24 (mol)
Mà: H% = 80%
⇒ nO2 = 0,24.80% = 0,192 (mol)
\(\Rightarrow V_{O_2}=0,192.22,4=4,3008\left(l\right)\)
Bạn tham khảo nhé!

\(n_{O_2}=\dfrac{43.2}{32}=1.35\left(mol\right)\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(0.9...........................1.35\)
\(H\%=\dfrac{0.9}{1}\cdot100\%=90\%\)
PT: \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
______1_____________1,5 (mol)
⇒ mO2 (lí thuyết) = 1,5.32 = 48 (g)
Mà: mO2 (thực tế) = 43,2 (g)
\(\Rightarrow H\%=\dfrac{43,2}{48}.100\%=90\%\)
Bạn tham khảo nhé!

PTHH: \(2KClO_3\rightarrow2KCl+3O_2\)
\(1\rightarrow1,5\left(mol\right)\)
Theo phương trình: \(n_{O_2lt}=\dfrac{1.3}{2}=1,5\left(mol\right)\)
Khối lượng \(O_2\) thu được theo lý thuyết là :
\(m_{O_2lt}=1,5.32=48\left(g\right)\)
Hiệu suất phản ứng là:
\(H=\dfrac{43,2}{44}.100\%=90\%\)

Tính hiệu suất phản ứng điều chế oxi từ kaliclorat biết rằng đi từ 24,5g KClO3 thu được 5,376 lít khí oxi (đktc).
---------
nKClO3= 24,5/122,5=0,2(mol)
nO2(TT)= 5,376/22,4= 0,24 (mol)
PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
0,2______________________0,3(mol)
nO2(LT)= 0,3(mol)
=> H = (0,24/0,3).100= 80%

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

2KClO3--->2KCl+302
nKClO3=122,5:122,5=1 mol
nO2=43,2:32=1,35 mol
So sánh nKClO3/2 > nO2 --->nO2 hết KClO3 dư tính theo O2
(=0,5) (=0,45)
Theo pt -->nKClO3 thực =nO2=1,35
mKClO3=1,35.122,5=165,375 g
H=(165,375/122.5).100%=135%
Mình nhầm bạn nhá phải là nKClO3=nO2.2/3=1,35.2/3=0,9 mol
g KClO3 tt=0,9 mol
H=(0,9/1).100%=90%

\(n_{O_2}=\frac{43,2}{32}=1,35mol\)
PTHH: \(2KClO_3\rightarrow^{t^o}2KCl+3O_2\uparrow\)
Theo phương trình \(n_{KClO_3\left(p/ứ\right)}=\frac{2}{3}n_{O_2}=0,9mol\)
\(\rightarrow H=\frac{0,9.122,5}{122,5}.100\%=90\%\)
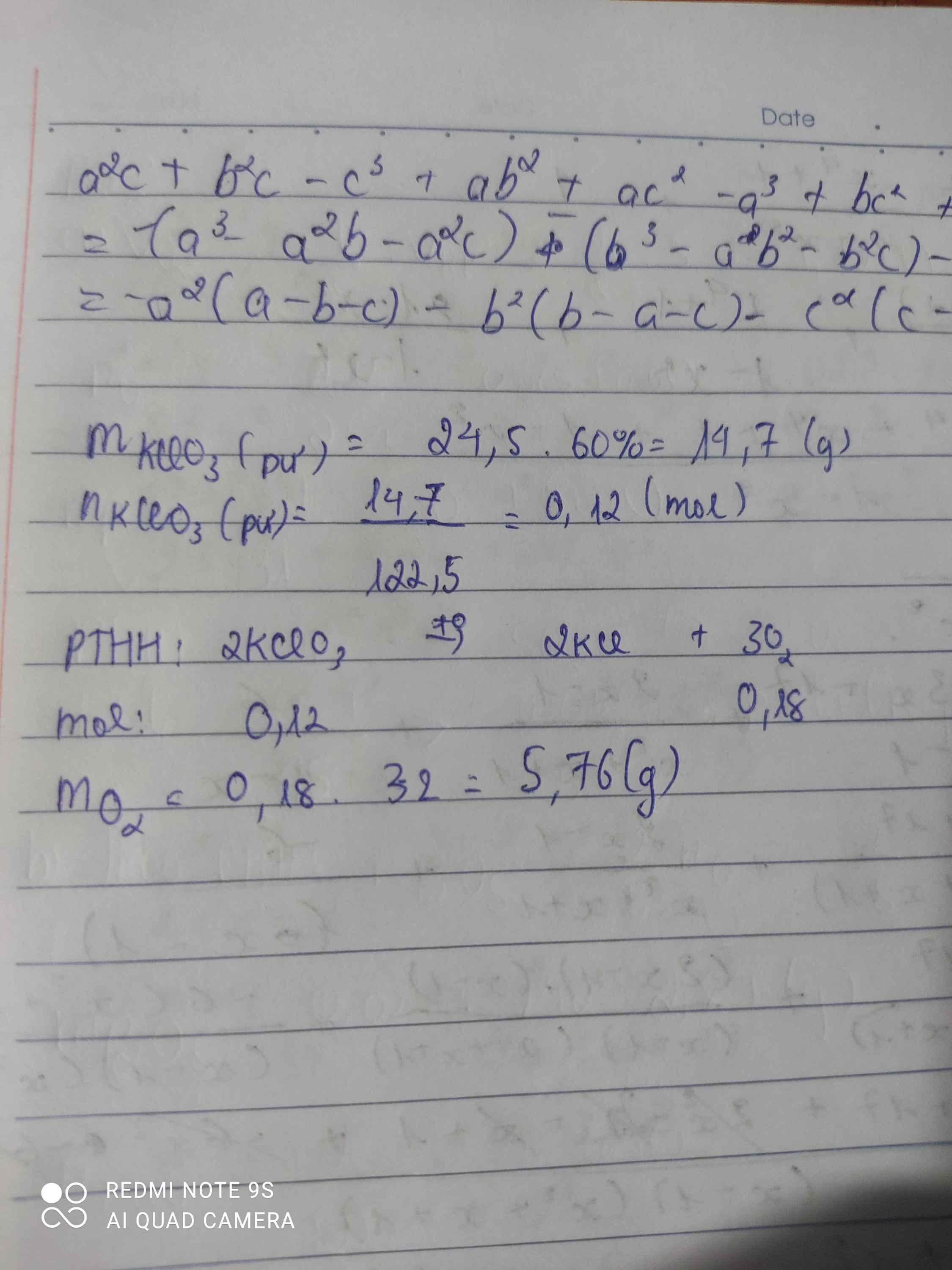
C1
\(m_{KClO_3\left(pư\right)}=\dfrac{24,5.60}{100}=14,7\left(g\right)\)
\(n_{KClO_3\left(pư\right)}=\dfrac{14,7}{122,5}=0,12\left(mol\right)\)
PTHH: 2KClO3 --to--> 2KCl + 3O2
0,12--------->0,12--->0,18
=> \(m_{O_2}=0,18.32=5,76\left(g\right)\)
C2: \(m_{KCl}=0,12.74,5=8,94\left(g\right)\)
Theo ĐLBTKL: \(m_{KClO_3\left(pư\right)}=m_{KCl}+m_{O_2}\)
=> \(m_{O_2}=14,7-8,94=5,76\left(g\right)\)
ta có
\(n_{KClO_3}=\dfrac{24.5}{122,5}=0,2\left(mol\right)\)
PTHH : \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
0,2 0,3 ( mol)
Mà H = 60 %
\(\Rightarrow n_{O_2}=0,3.60\%=0,18\left(mol\right)\\ \Rightarrow m_{O_2}=0,18.32=5,76\left(g\right)\)