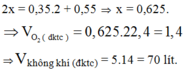Đốt cháy V(lit) khí C2H6 cần dùng 56 lít không khí ở đktc thu đc khí cacbonic và nước. Biết trong không khí oxi chiếm 20% thể tích. Tính V ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a/ PTHH : 2C2H6 + 7O2 → 6H2O + 4CO2
nC2H6 = 13,44 / 22,4 = 0,6 mol
=> nO2 = 2,1 mol
=> VO2 = 2,1 x 22,4 = 47,04 lít
=> VKK = 47,04 : 0,2 = 235,3 lít
b/ => nCO2 = 1,2 mol
=> mCO2 = 1,2 x 44 = 52,8 gam

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
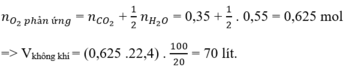

a) CH4 + 2O2 --to--> CO2 + 2H2O
b) \(V_{O_2}=\dfrac{56}{5}=11,2\left(l\right)\)
=> \(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
_____0,25<--0,5-------->0,25
=> VCH4 = 0,25.22,4 = 5,6 (l)
c)
mCO2 = 0,25.44 = 11 (g)

2H2+O2-to>2H2O
0,2----0,1-----0,2
n H2=0,2 mol
=>m H2O=0,2.18=3,6g
=>Vkk=0,1.22,4.5=11.2l
a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2H2 + O2 ----to----> 2H2O
Mol: 0,2 0,1 0,2
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)
b, \(V_{O_2}=0,1.22,4=2,24\left(l\right)\Rightarrow V_{kk}=2,24.5=11,2\left(l\right)\)

\(n_{C_2H_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\\ a,2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\\ b,n_{CO_2}=0,125.2=0,25\left(mol\right)\\ m_{CO_2}=0,25.44=11\left(g\right)\\ c,n_{O_2}=\dfrac{5}{2}.0,125=0,3125\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,3125.22,4=7\left(l\right)\\ \Rightarrow V_{kk\left(đktc\right)}=\dfrac{100}{20}.7=35\left(l\right)\)