Đốt cháy hoàn toàn 4,48l hỗn hợp khí gồm C4H8 và C2H4 trong kk.Sau phản ứng thu đc CO2 và H2O ( các khí đo ở cùng điều kiện ) , biết trong hh C2H4 chiếm 75% về thể tích.Hãy tính thể tích O2 đã phản ứng và CO2 thu đc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{hh}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(n_{C_2H_4}=75\%\cdot0.2=0.15\left(mol\right)\)
\(\Rightarrow n_{C_4H_8}=0.2-0.15=0.05\left(mol\right)\)
\(C_2H_4+3O_2\underrightarrow{^{^{t^0}}}2CO_2+2H_2O\)
\(C_4H_8+6O_2\underrightarrow{^{^{t^0}}}4CO_2+4H_2O\)
\(V_{O_2}=\left(0.15\cdot3+0.05\cdot6\right)\cdot22.4=16.8\left(l\right)\)
\(V_{CO_2}=\left(0.15\cdot2+0.05\cdot4\right)\cdot22.4=11.2\left(l\right)\)

a) Gọi số mol C2H4, C3H6 là a, b (mol)
=> \(a+b=\dfrac{3,36}{22,4}=0,15\left(mol\right)\) (1)
\(n_{CO_2}=\dfrac{17,6}{44}=0,4\left(mol\right)\)
PTHH: C2H4 + 3O2 --to--> 2CO2 + 2H2O
a----->3a--------->2a
2C3H6 + 9O2 --to--> 6CO2 + 6H2O
b------>4,5b------->3b
=> 2a + 3b = 0,4 (2)
(1)(2) =>a = 0,05 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,05}{0,15}.100\%=33,33\%\\\%V_{C_3H_6}=\dfrac{0,1}{0,15}.100\%=66,67\%\end{matrix}\right.\)
b) nO2 = 3a + 4,5b = 0,6 (mol)
=> VO2 = 0,6.22,4 = 13,44 (l)
Gọi a (mol) và b (mol) lần lượt là số mol của C2H4 và C3H6, ta có:
Giả thiết: a+b=3,36/22,4=0,15 (1).
BT C: 2a+3b=17,6/44=0,4 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra a=0,05 (mol) và b=0,1 (mol).
a. %V\(C_2H_4\)=0,05/0,15.100%\(\approx\)33,33% \(\Rightarrow\) %V\(C_3H_6\)\(\approx\)100%-33,33%\(\approx\)66,67%.
b. nnước=0,5.(0,05.4+0,1.6)=0,4 (mol).
BTKL: m\(O_2\)=17,6+0,4.18-(0,05.28+0,1.42)=19,2 (g) \(\Rightarrow\) n\(O_2\)=19,2/32=0,6 (mol).
Thể tích cần tìm là 0,6.22,4=13,44 (lít).

a) CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O.
C2H4 + 3O2 \(\underrightarrow{t^o}\) 2CO2 + 2H2O.
b) Gọi x là lượng CH4 ban đầu, lượng C2H4 ban đầu là 2x.
Ta có: x+2x=13,44/22,4 \(\Rightarrow\) x=0,2.
Thể tích khí CO2 sinh ra là \(V_{CO_2}\)=(0,2+0,2.2.2).22,4=22,4 (lít).

Ta có n(O2 dư) = 0,2 mol; n(CO2) = 0,4 mol; n(H2O) = 0,5 mol
Áp dụng ĐLBT nguyên tố Oxi: n(O2 đã dùng) = n(O2 dư) + n(CO2) + ½ n(H2O) = 0,85 mol
→ n(N2) = 3,4 mol → Đáp án C

\(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow a + b = \dfrac{3,36}{22,4} = 0,15(1) \)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ n_{CO_2} = a + 2b = \dfrac{4,48}{22,4} = 0,2(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,05
Suy ra:
\(\%V_{CH_4} = \dfrac{0,1}{0,15}.100\% = 66,67\%\\ \%V_{C_2H_4} = 100\% - 66,67\% = 33,33\%\)
b)
\(C_2H_4 + Br_2 \to C_2H_4Br_2\\ n_{Br_2} = n_{C_2H_4} = 0,05(mol)\\ \Rightarrow m_{Br_2} = 0,05.160 = 8\ gam\)

Đáp án A
- Trộn 2x mol O 2 với 5x mol không khí (gồm x mol O 2 ,4x mol N 2 ) được hỗn hợp X chứa 3x mol O 2 , 4x mol N 2 .
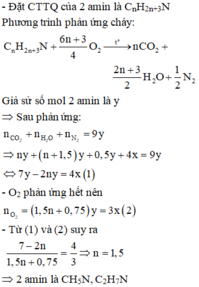

Đáp án A

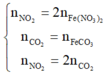
![]()

n S O 2 = 8 , 75 % n Y → b = 8 , 75 % ( 3 a + b + 4 c ) B T N T ( O ) : 3 a + 6 a + 2 c = 3 a + 1 , 5 b + 2 a + 2 b + 4 a → c = 1 , 75 a
→ b = 7 8 a
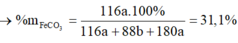

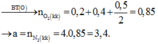
\(n_{C_2H_4}=\dfrac{4,48.75\%}{22,4}=0,15\left(mol\right)\)
\(n_{C_4H_8}=\dfrac{4,48}{22,4}-0,15=0,05\left(mol\right)\)
PTHH: C4H8 + 6O2 --to--> 4CO2 + 4H2O
0,05--->0,3------>0,2
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,15--->0,45------>0,3
=> \(V_{CO_2}=\left(0,2+0,3\right).22,4=11,2\left(l\right)\)
\(V_{O_2}=\left(0,3+0,45\right).22,4=16,8\left(l\right)\)