Cho 23,8 gam hỗn hợp X (Cu, Fe, Al) tác dụng vừa đủ 14,56 lít khí Cl2 ( đktc). Mặt khác cứ 0,25 Mol hỗn hợp tác dụng với dung dịch HCl dư thu được 0,2 Mol khí ( đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%

Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
nCl2nCl2 = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
%Cu=0,2.6423,8≈53,78%%Cu=0,2.6423,8≈53,78%
%Fe=0,1.5623,8≈23,53%%Fe=0,1.5623,8≈23,53%
%Al ≈ 22,69%

Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)

Gọi $n_{Fe} = a(mol), n_{Zn} = b(mol) , n_{Al} = c(mol) \Rightarrow 56a + 65b + 27c = 20,4(1)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$Zn + H_2SO_4 \to ZnSO_4 + H_2$
$2Al +3 H_2SO_4 \to Al_2(SO_4)_3 +3 H_2$
Theo PTHH : $n_{H_2} = a + b + 1,5c = \dfrac{10,08}{22,4} = 0,45(mol)(2)$
Mặt khác :
$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$Zn + Cl_2 \xrightarrow{t^o} ZnCl_2$
$2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$
Theo PTHH : $n_{Cl_2} = 1,5n_{Fe} + n_{Zn} + 1,5n_{Al}$
Suy ra : \dfrac{1,5a + b + 1,5c}{a + b + c} = \dfrac{0,275}{0,2}(3)$
Từ (1)(2)(3) suy ra : a = 0,2 ; b = 0,1 ; c = 0,1
$\%m_{Fe} = \dfrac{0,2.56}{20,4}.100\% = 54,9\%$
$\%m_{Zn} = \dfrac{0,1.65}{20,4}.100\% = 31,9\%$
$\%m_{Al} = 100\% - 54,9\% - 31,9\% = 13,2\%$

\(n_{Cu}=a\left(mol\right),n_{Fe}=b\left(mol\right),n_{Al}=c\left(mol\right)\)
\(m_X=64a+56b+27b=35.7\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{21.84}{22.4}=0.975\left(mol\right)\)
\(Cu+Cl_2\underrightarrow{^{^{t^0}}}CuCl_2\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(Al+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}AlCl_3\)
\(n_{Cl_2}=a+1.5b+1.5c=0.975\left(mol\right)\left(2\right)\)
\(n_{hh}=ka+kb+kc=0.25\left(mol\right)\)
\(n_{H_2}=kb+k\cdot1.5c=0.2\left(mol\right)\)
\(\Leftrightarrow a-0.25b-0.875c=0\left(3\right)\)
\(\left(1\right),\left(2\right),\left(3\right):a=0.3,b=0.15,c=0.3\)
\(\%Cu=\dfrac{0.3\cdot64}{35.7}\cdot100\%=53.78\%\)
\(\%Fe=\dfrac{0.15\cdot56}{35.7}\cdot100\%=23.52\%\)
\(\text{%Al=22.7%}\)

Đáp án D
Xét trường hợp 20,4 gam A tác dụng với dung dịch HCl dư:
Gọi số mol các chất là Al: a mol; Zn: b mol; Fe: c mol
Ta có:

Các quá trình nhường, nhận electron:
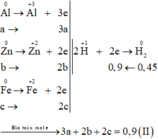
Xét trường hợp 0,2 mol A tác dụng với Cl2:
Gọi số mol các chất là Al: ka mol; Zn: kb mol; Fe: kc mol
Ta có:
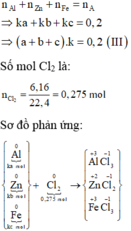
Các quá trình nhường, nhận electron:
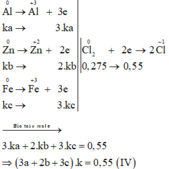
Lấy (IV) chia (III) vế với vế ta được:


Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

a)
TN1: Gọi (nZn; nFe; nCu) = (a; b; c)
=> 65a + 56b + 64c = 18,5 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
a---------------------->a
Fe + 2HCl --> FeCl2 + H2
b----------------------->b
=> a + b = 0,2 (2)
TN2: Gọi (nZn; nFe; nCu) = (ak; bk; ck)
=> ak + bk + ck = 0,15 (3)
PTHH: Zn + Cl2 --to--> ZnCl2
ak-->ak
2Fe + 3Cl2 --to--> 2FeCl3
bk--->1,5bk
Cu + Cl2 --to--> CuCl2
ck-->ck
=> \(ak+1,5bk+ck=\dfrac{3,92}{22,4}=0,175\)(4)
(1)(2)(3)(4) => \(\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\c=0,1\left(mol\right)\\k=0,5\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,1.65}{18,5}.100\%=35,135\%\\\%m_{Fe}=\dfrac{0,1.56}{18,5}.100\%=30,27\%\\\%m_{Cu}=\dfrac{0,1.64}{18,5}.100\%=34,595\%\end{matrix}\right.\)
b) nO(oxit) = \(\dfrac{23,7-18,5}{16}=0,325\left(mol\right)\)
=> nH2O = 0,325 (mol)
=> nHCl = 0,65 (mol)
=> \(V=\dfrac{0,65}{1}=0,65\left(l\right)=650\left(ml\right)\)

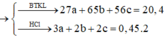
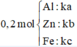
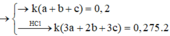
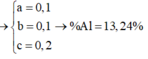
Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
nCl2nCl2 = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
%Cu=0,2.6423,8≈53,78%%Cu=0,2.6423,8≈53,78%
%Fe=0,1.5623,8≈23,53%%Fe=0,1.5623,8≈23,53%
%Al ≈ 22,69%