Một dung dịch 42,6 gam một hỗn hợp 2 muối natri của 2 halogen kế tiếp nhau trong bảng tuần hoàn tác dụng với dung dịch agNO3 dư sau phản ứng thu được 85,1 gam xác định công thức 2 muối ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Nếu chỉ một trong hai muối tác dụng với Bạc nitrat :
Suy ra hai muối là NaCl và NaF
\(AgNO_3 + NaCl \to AgCl + NaNO_3\\ n_{NaCl} = n_{AgCl} = \dfrac{43,2}{143,5} = 0,3(mol)\\ \Rightarrow m_{NaCl} = 0,3.58,5 = 17,55 < 25,3(\text{thỏa mãn})\)
- Nếu cả hai muối đều tác dụng với Bạc nitrat :
Gọi CTTQ của hai muối : NaX
\(NaX + AgNO_3 \to AgX + NaNO_3\\ n_{NaX} = n_{AgX} \\ \Leftrightarrow \dfrac{25,3}{23 + X} = \dfrac{43,2}{108+X}\\ \Rightarrow X = 97,13\\ M_{Br} = 80 < M_X = 97,13 < M_I = 127\)
Vậy hai muối là NaBr và NaI

Đáp án D
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
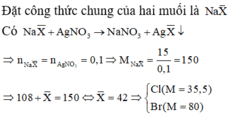
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
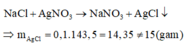
Do đó trường hợp này không thỏa mãn.

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
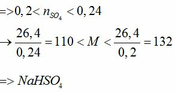
b)
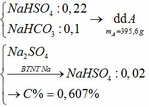
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

+) Trường hợp 1: Hỗn hợp gồm NaF và NaCl
PTHH: \(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Ta có: \(n_{AgCl}=\dfrac{2,87}{143,5}=0,02\left(mol\right)=n_{NaCl}\)
\(\Rightarrow m_{NaCl}=0,02\cdot58,5=1,17\left(g\right)\) \(\Rightarrow m_{NaF}=0,415\left(g\right)\)
+) Trường hợp 2: Hỗn hợp không chứa NaF
Gọi công thức chung 2 muối là NaR
PTHH: \(NaR+AgNO_3\rightarrow NaNO_3+AgR\downarrow\)
Theo PTHH: \(n_{NaR}=n_{AgR}\) \(\Rightarrow\dfrac{1,595}{23+\overline{M}_R}=\dfrac{2,87}{108+\overline{M}_R}\)
\(\Rightarrow\overline{M}_R\approx83,3\) \(\Rightarrow\) 2 halogen cần tìm là Brom và Iot
Vậy 2 muối có thể là (NaF và NaCl) hoặc (NaBr và NaI)
*P/s: Các phần còn lại bạn tự làm

Tăng giảm khối lượng ta có; $n_{NaX}=\frac{2,35-1,5}{108-23}=0,01(mol)$
$\Rightarrow M_{NaX}=150\Rightarrow X=127$
Vậy CTHH của muối là NaI
Bảo toàn nguyên tố X và Ag ta có: $n_{AgNO_3}=n_{AgI}=0,01(mol)\Rightarrow C_{M}=1M$
PTHH: \(NaX+AgNO_3\rightarrow NaNO_3+AgX\downarrow\)
Theo PTHH: \(n_{NaX}=n_{AgX}\)
\(\Rightarrow\dfrac{1,5}{23+X}=\dfrac{2,35}{108+X}\) \(\Leftrightarrow X=127\) (Iot)
\(\Rightarrow\) Công thức: NaI
Ta có: \(n_{AgNO_3}=n_{NaI}=\dfrac{1,5}{150}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{AgNO_3}}=\dfrac{0,01}{0,01}=1\left(M\right)\)

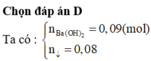

- Nếu trong hh muối có NaF => muối còn lại là NaCl
(Thử lại => Thỏa mãn)
- Nếu trong hh muối không có NaF
Gọi công thức chung của 2 muối là NaX
\(n_{NaX}=\dfrac{42,6}{23+M_X}\left(mol\right)\)
PTHH: NaX + AgNO3 --> AgX + NaNO3
\(\dfrac{42,6}{23+M_X}\)-------->\(\dfrac{42,6}{23+M_X}\)
=> \(\dfrac{42,6}{23+M_X}\left(108+M_X\right)=85,1\)
=> MX = 62,2
Mà 2 halogen kế tiếp nhau
=> 2 halogen là Cl và Br
=> CTHH 2 muối là NaCl và NaBr