Câu 9: Cho m gam Cu tác dụng hết với axit nitric đặc, thu được 32,9 gam muối Cu(NO3)2 và V
lít khí NO 2 (sản phẩm khử duy nhất) ở đktc. Giá trị của V
Câu 10: Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 50% ; %mH = 5,55% còn lại là oxi.
Tỉ khối hơi của X so với không khí bằng 2,483. Công thức phân tử của X
Câu 11: Cho 4,2 gam Fe tác dụng hết với axit nitric loãng dư, thu được V lít khí NO (sản phẩm
khử duy nhất) ở đktc. Giá trị của V


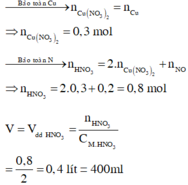
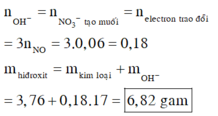


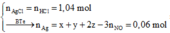
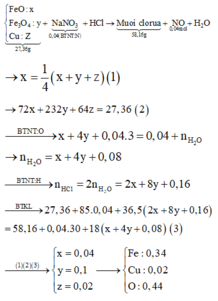
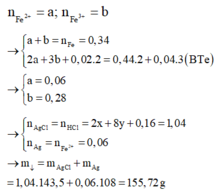
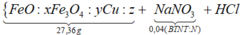
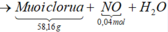
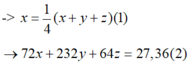
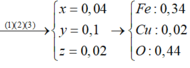
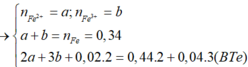
Câu 9
\(n_{Cu\left(NO_3\right)_2}=\dfrac{32,9}{188}=0,175\left(mol\right)\)
PTHH: Cu + 4HNO3 --> Cu(NO3)2 + 2NO2 + 2H2O
0,175----->0,35
=> VNO2 = 0,35.22,4 = 7,84(l)
Câu 10:
MX = 2,483.29 = 72(g/mol)
Giả sử có 1 mol chất X => mX = 1.72 = 72 (g)
\(m_C=\dfrac{72.50}{100}=36\left(g\right)=>n_C=\dfrac{36}{12}=3\left(mol\right)\)
\(m_H=\dfrac{5,55.72}{100}=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
\(m_O=72-36-4=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> Trong 1 mol X có 3 mol C, 4 mol H, 2 mol O
=> CTPT: C3H4O2
Câu 11:
\(n_{Fe}=\dfrac{4,2}{56}=0,075\left(mol\right)\)
PTHH: Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
0,075------------------------>0,075
=> VNO = 0,075.22,4 = 1,68(l)