Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol của kẽm
nZn = \(\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Pt : Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,1 0,2 0,1
a) Số mol của khí hidro
nH2 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Thể tích của hidro
VH2= nH2 . 22,4
= 0,1 . 22,4
= 2,24 (l)
b) Số mol của axit clohidric
nHCl = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Thể tich của axit clohidric đã dùng
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,2}{2}=0,1\left(l\right)\)
Chúc bạn học tốt

Chọn đáp án B
n H 2 = 6 , 72 22 , 4 = 0,3 (mol)
=> n H C l = 2 n H 2 = 0,6 (mol)
Bảo toàn khối lượng: 16,1 + 0,6.36,5 = m + 0,3.2 => m = 37,40 gam

Ta có sơ đồ phản ứng:
m(gam) (Mg, Fe) + --O2→ (m+4,16) gam B + --HCl→ D (Mg2+ x mol; Fe2+ y mol; Fe3+ z mol); Cl-)
D + --AgNO3→ (11m – 12,58) gam (Ag + AgCl)
Ta có m(O) = 4,16 gam → n(O) = 0,26 mol → n(Cl- trong D) = 0,52 mol
→ n(AgCl) = 0,52 mol
Ta có hệ phương trình
(1): 24x + 56(y+z) = m
(2) ĐLBT điện tích: 2x+2y+ 3z = 0,52
(3) m + 0,52*35,5 = 4m-6,5
→ m = 8,32 gam → n(Ag) = 0,04 = y → x = 0,16; z = 0,04
Mặt khác trong 4,5m gam A có: Mg = 0,72 mol và Fe 0,36 mol
Dung dịch muối: Mg2+: 0,72 mol; Fe3+: 0,36mol; NH4+: t mol; NO3-: q mol
hợp khí F gồm N2 (0,04 mol) và N2O (0,04 mol)
Áp dụng ĐLBT mol e: → t = 0,225 mol
Áp dụng ĐLBT điện tích → q = 2,745 mol → m 211,68 gam → Đáp án C
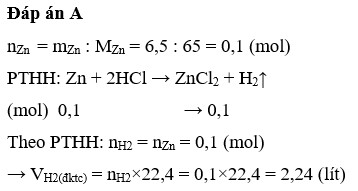
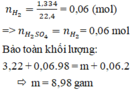

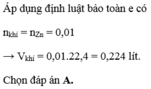
nH2 = 2.24/22.4 = 0.1 (mol)
Zn + 2HCl => ZnCl2 + H2
nZn = nH2 = 0.1 (mol)
mZn = 0.1*65 = 6.5 (g)
=> C
Phương trình Zn + 2HCl => ZnCl2 + H2
nH2 = 2,24/22,4 = 0,1 mol
theo pt : nZn = nH2 = 0,1 mol => mZn = 0,1.65 = 6,5g