Trộn 200ml dd KOH 1M vào V ml dung dịch ZnCl2 2M rồi khuấy thật đều.Sau khi khuấy dung dịch trở nên trong suốt và thu được 4,95g kết tủa. Tính V?
A. 5ml. B.3,75ml C. 10ml D. 37,5ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

+Khi thêm 300 ml dd KOH vào 200 ml dd AlCl3 thì
\(n_{OH^-}=n_{KOH}=0,3.2=0,6\left(mol\right)\)
\(n_{Al\left(OH\right)_{3kt}}=\frac{15,6}{78}=0,2\left(mol\right)\)
PT ion : \(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_{3_{Kt}}\)
______________0,6 _____ 0,2 mol
Ta thấy \(n_{OH^-_{Pu}}=3.n_{Al\left(OH\right)_3}\) \(\rightarrow\) Kết tủa chưa bị hòa tan
\(\rightarrow n_{Al^{3+}_{PU}}=n_{Al\left(OH\right)3}=0,2\left(mol\right)\)
+Khi thêm tiếp 200 ml dd KOH vào cốc thì
\(n_{OH^-}=n_{KOH}=0,2.2=0,4\left(mol\right)\)
nAl(OH)3 kết tủa ở phản ứng sau = 21,84 - 15,6 = 6,24 g
\(\rightarrow n_{Al\left(OH\right)3}=\frac{6,24}{78}=0,08\left(mol\right)\)
PT ion :\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_{3_{Kt}}\)
________________0,4___0,08 mol
Ta thấy \(n_{OH^-}>3.n_{Al\left(OH\right)_3}=0,4>3.0,08\)
\(\rightarrow\) Kết tủa bị hòa tan một phần
Áp dụng CT : \(n_{Al\left(OH\right)3}=4.n_{Al^{3+}}-n_{OH^-}\)
\(\Leftrightarrow0,08=4.n_{Al^{3+}}-0,4\rightarrow n_{Al^{3+}}=0,12\left(mol\right)\)
Vậy tổng nAl(3+) đã pư ( tức là nAlCl3 đã pư )
\(=0,2+0,12=0,32\left(mol\right)\)
\(\rightarrow CM_{ddAlCl3}=\frac{0,32}{0,2}=1,6M\)

Đáp án C
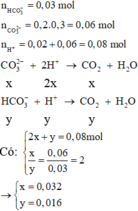
=> V=22,4.(x+y)=1,0752 lít
Dung dịch X chứa 0,028 mol CO 3 2 - , 0,014 mol HCO 3 - , 0,06 mol SO 4 2 - , Na + , K +
Thêm: n OH - = 0 , 06 mol , n Ba 2 + = 0 , 15 mol vào dung dịch X.
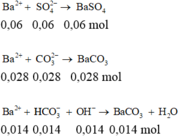
Sau phản ứng dư Ba2+, OH-
n kết tủa = 197 . ( 0 , 028 + 0 , 014 ) + 233 . 0 , 06 = 22 , 254 gam

Đáp án A
Chú ý đổ từ từ muối Na2CO3 và NaHCO3 vào dung dịch H2SO4 thì xảy ra đồng thời các phương trình ( HSO4- coi như chất điện ly hoàn toàn tạo ra SO42- và H+)
2H+ + CO32- → CO2 + H2O (1)
2x------> x
H+ + HCO3- → CO2 + H2O (2)
y -----> y
Ta có 2x+ y = 0,08 mol
Vì phản ứng xảy ra đồng thời nên x: y = nCO32- : nHCO3- = 0,06 : 0,03 = 2:1
Ta có hệ 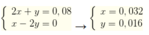
Vậy nCO2 = 0,032 + 0,016 = 0,048 mol → V= 1,0752 l
Vậy dung dịch X chứa : HCO3- dư : 0,014 mol, CO32- :0,028 mol, SO42-:0,06 mol
Khi cho 0,15 mol BaCl2 và 0,06 mol KOH vào dung dịch X xảy ra các pt sau:
HCO3- + OH- → CO32- + H2O
0,014--- 0,06 ----> 0,014
Ba2+ + CO32- → BaCO3↓
0,15 ----0,042 ----> 0,042
SO42- + Ba2+ → BaSO4↓
0,06---------------> 0,06
Vậy mkết tủa = 0,06×233+ 0,042×197 = 22,254 gam

Đáp án : C
0 , 03 m o l N a H C O 3 0 , 06 m o l K 2 C O 3 nhỏ từ từ 0 , 02 m o l H C l 0 , 06 m o l K H S O 4
=> 2 muối kiềm sẽ phản ứng theo tỉ lệ mol 1:2
Đặt số mol NaHCO3 phản ứng là x => số mol KCO3 phản ứng là 2x
=> nH+ = 0,02 + 0,06 = x + 2.2x => x = 0,016 mol
=> Sau phản ứng có : 0,014 mol HCO3- ; 0,028 mol CO32- và 0,06 mo SO42-
Khi cho X vào dung dịch chứa : 0,06 mol KOH và 0,15 mol BaCl2
=> nCO3 = 0,014 + 0,028 = 0,042 mol ; nSO4 = 0,06 mol
=> m kết tủa = mBaCO3 + mBaSO4 = 22,254g

Đáp án B
Cho từ từ 0,03 mol NaHCO3 và 0,06 mol K2CO3 vào 0,02 mol HCl và 0,06 mol NaHSO4 thu được dung dịch X

\(n_{KOH}=0,2\left(mol\right)\)
\(n_{ZnCl_2}=0,001.2.V=0,002V\left(mol\right)\)
\(n_{Zn\left(OH\right)_2}=\dfrac{4,95}{99}=0,05\left(mol\right)\)
PTHH: 2KOH + ZnCl2 --> Zn(OH)2 + 2KCl
____0,004V<-0,002V-->0,002V
Zn(OH)2 + 2KOH --> K2ZnO2 + 2H2O
(0,1-0,002V)<--(0,2-0,004V)
=> 0,002V - (0,1-0,002V) = 0,05
=> V = 37,5 (ml)
=> D