Hợp chất khí A có thành phần phần trăm theo khối lượng là: 80%C và 20% H. Hãy xaùc ñònh công thức hoá
học của hợp chất A, biết tỉ khối của A so với khí hiđro là 15.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Gọi CTHH của A: CxHy
Ta có tỉ lệ: \(\dfrac{80}{12}\):\(\dfrac{20}{1}\)∼6,667:20∼1:3
Vậy CTHH: CH3
Ta so sánh \(\dfrac{CH3}{H}\)=\(\dfrac{15}{1}\)(Với chỉ Hidro ko phải là khí nên mik ghĩ vậy)=15
Vậy CTHH của A là CH3

a)
\(M_A = M_{H_2}.15 = 15.2 = 30(đvC)\)
Số nguyên tử C = \(\dfrac{30.80\%}{12} = 2\)
Số nguyên tử H = \(\dfrac{30.20\%}{1} = 6\)
Vậy CTHH của A : C2H6.
b)
\(M_{FeS_2} = 120(đvC)\)
\(\%Fe = \dfrac{56}{120}.100\% = 46,67\%\\ \%S = 100\% - 46,67\% = 53,33\%\)
c)
Số nguyên tử Kali = \(\dfrac{94.82,98\%}{39} = 2\)
Số nguyên tử Oxi = \(\dfrac{94-39.2}{16} = 1\)
Vậy CTHH cần tìm K2O
a) A : CxHy
x : y = 80/12 : 20/1 = 1 : 3
CT đơn giản : (CH3)n
M = 15*2=30
=> 15n = 30 => n=2
CT: C2H6
b)
MFeS2 = 120 (đvc)
%Fe = 56/120 * 100% = 46.67%
%S = 53.33%
c)
Gọi: CT : KxOy
%O = 100 -82.98 = 17.02%
x : y = 82.98/39 : 17.02/16 = 2 : 1
CT đơn giản : (K2O)n
M = 94 => 94n=94 => n = 1
CTHH : K2O

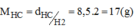
Khối lượng của nito trong 1 mol hợp chất:
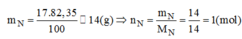
Khối lượng của hidro trong 1 mol hợp chất:
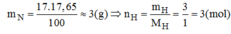
Vậy trong hợp chất có 1 mol nguyên tử N và 3 mol nguyên tử H.
→ Công thức hóa học đơn giản của hợp chất là N H 3

MX = 8,5.2 = 17 (g/mol)
\(m_N=\dfrac{17.82,35}{100}=14\left(g\right)=>n_N=\dfrac{14}{14}=1\left(mol\right)\)
\(m_H=\dfrac{17,65.17}{100}=3\left(g\right)=>n_H=\dfrac{3}{1}=3\left(mol\right)\)
=> CTHH:NH3
\(M_X=8,5.2=17(g/mol)\)
Trong 1 mol X: \(\begin{cases} n_N=\dfrac{17.82,35\%}{14}=1(mol)\\ n_H=\dfrac{17.17,65\%}{1}=3(mol) \end{cases}\)
Vậy \(CTHH_X:NH_3\)

a) \(M_A=d.M_{H_2}=8,5.2=17\)
\(m_N=\dfrac{17.82,35}{100}=14\left(g\right)\)
\(m_H=\dfrac{17.17,65}{100}=3\left(g\right)\)
\(n_N=\dfrac{m}{M}=\dfrac{14}{14}=1\left(mol\right)\)
\(n_H=\dfrac{m}{M}=\dfrac{1}{1}=1\left(mol\right)\)
⇒ CTHH: \(NH_3\)
b) \(N_2+3H_2\rightarrow2NH_3\)
\(\dfrac{1}{40}\leftarrow\dfrac{3}{40}\leftarrow\dfrac{1,12}{22,4}\) ( mol )
Số nguyên tử N trong 0,025 mol phân tử N2:
\(A=n.N=0,025.6,023.10^{23}=1,506.10^{22}\) ( nguyên tử )
Số nguyên tử H trong 0,025 mol phân tử H2:
\(A=n.N=\dfrac{3}{40}.6,023.10^{23}=4,517.10^{22}\) ( nguyên tử )

\(a.\)
\(GS:\)
\(n_{hh}=1\left(mol\right)\)
\(Đặt:n_{N_2}=a\left(mol\right),n_{CO_2}=b\left(mol\right)\)
\(\Rightarrow a+b=1\left(1\right)\)
\(m_A=28a+44b=18\cdot2=36\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.5\)
\(\%m_{N_2}=\dfrac{0.5\cdot28}{0.5\cdot28+0.5\cdot44}\cdot100\%=38.89\%\)
\(\%m_{CO_2}=61.11\%\)
\(b.\)
\(\dfrac{n_{N_2}}{n_{CO_2}}=\dfrac{0.5}{0.5}=\dfrac{1}{1}\)
\(n_{N_2}=n_{CO_2}=\dfrac{1}{2}\cdot n_A=\dfrac{0.2}{2}=0.1\left(mol\right)\)
\(Đặt:n_{CO_2}=x\left(mol\right)\)
\(\overline{M}=\dfrac{0.1\cdot28+0.1\cdot44+44x}{0.2+x}=20\cdot2=40\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow x=0.2\)
\(m_{CO_2\left(cầnthêm\right)}=0.2\cdot44=8.8\left(g\right)\)
MA = 15.2 = 30(g/mol)
\(m_C=\dfrac{30.80}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{20.30}{100}=6\left(g\right)=>n_H=\dfrac{6}{1}=6\left(mol\right)\)
=> CTHH: C2H6
\(M_A=15.2=30\left(\dfrac{g}{mol}\right)\)
\(m_C=\dfrac{30.80}{100}=24g\)
\(m_H=\dfrac{30.20}{100}=6g\)
\(n_C=\dfrac{24}{12}=2mol\)
\(n_H=\dfrac{6}{1}=6mol\)
=> CTHH: C2H6