Cho hỗn hợp Al và Mg tác dụng hết với dung dịch HCl dư, thấy bay ra 2,24 lít H2 (đktc). Cũng cho lượng hỗn hợp trên tác dụng với dung dịch NaOh dư thu được 1,2g chất rắn không tan. Tính thành phần phần trăm các kim loại trong hỗn hợp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi cho hỗn hợp Al, Fe, Zn vào dung dịch NaOH dư thì chỉ có Zn và Al tham gia phản ứng tạo H2(0,225 mol), phần chất rắn không tan là Fe
Cho Fe phản ứng với lượng dư HCl tạo ra 0,1 mol khí → nFe = nH2 = 0,1 mol → mAl + mZn= 16,7- 5,6 = 11,1
Gọi số mol của Al và Zn lần lượt là x, y
Ta có hệ 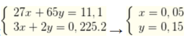
→ %Al = 0 , 05 . 27 16 , 7 ×100% = 8,08 %.
Đáp án D

Đáp án B
Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64%

Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64% → Đáp án B

Mg+2HCl->MgCl2+H2
a..............................a(mol)
Fe+2HCl->FeCl2+H2
b............................b(mol)
=>nCu=3,2/64=0,05mol
=>%mCu=(3,2.100%)/11,2=28,6%
\(=>\left\{{}\begin{matrix}24a+56b=11,2-3,2\\a+b=0,2\end{matrix}\right.=>\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
=>mMg=24.0,1=2,4g=>%Mg=(2,4.100%)/11,2=21,4%
=>%Fe=100%-21,4%-28,6%=50%
b, MgCl2+2NaOH->Mg(OH)2+2NaCL
FeCl2+2NaOH->Fe(OH)2+2NaCl
=>m(kết tủa)=mMg(OH)2+mFe(OH)2
=0,1(58+90)=14,8g
a) mCu= m(k tan)= 3,2(g)
=> m(Mg, Fe)= 11,2- 3,2=8(g)
nH2= 4,48/22,4=0,2(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
a______________2a__a______a(mol)
Fe + 2 HCl -> FeCl2 + H2
b____2b_____b_____b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24a+56b=8\\a+b=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}m_{Mg}=24.0,1=2,4\left(g\right)\\m_{Fe}=56.0,1=5,6\left(g\right)\end{matrix}\right.\)
=> %mMg= (2,4/11,2).100=21,429%
%mFe= (5,6/11,2).100=50%
=>%mCu= (3,2/11,2).100=28,571%
b/ MgCl2 + 2 NaOH -> Mg(OH)2 + 2 NaCl
0,1___________________0,1(mol)
FeCl2 + 2 NaOH -> Fe(OH)2 +2 NaCl
0,1__________________0,1(mol)
m(kt)=mMg(OH)2 + mFe(OH)2= 58.0,1+ 90.0,1= 14,8(g)
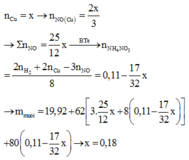
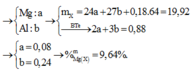

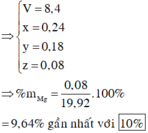
\(m_{Mg}=1,2\left(g\right)\)
=> \(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
____0,05--------------------->0,05
2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{30}\)<--------------------0,05
=> \(m_{Al}=\dfrac{1}{30}.27=0,9\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,9}{0,9+1,2}.100\%=42,857\%\\\%Mg=\dfrac{1,2}{0,9+1,2}.100\%=57,143\%\end{matrix}\right.\)