Hòa tan hòan tòan 18.8g hỗn hợp gồm Mg và Fe bằng dung dịch HCl dư thu được 10.08 lit khí (đktc).Tìm thành phần % khối lượng các kim loại trong hỗn hợp đầu .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Mg}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 24x+56y=4(1)\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ Mg+2HCl\to MgCl_2+H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow x+y=0,1(2)\\ (1)(2)\Rightarrow x=y=0,05(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,05.56}{4}.100\%=70\%\\ \Rightarrow \%_{Mg}=100\%-70\%=30\%\)

PTHH:
Fe + 2HCl ---> FeCl2 + H2
Cu + HCl ---x--->
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
=> \(m_{Fe}=0,2.56=11,2\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{11,2}{15,6}.100\%=71,79\%\)
=> \(\%_{m_{Cu}}=100\%-71,79\%=28,21\%\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 0,2
\(m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow\%m_{Fe}=\dfrac{11,2}{15,6}\cdot100\%\approx71,8\%\)
\(\Rightarrow\%m_{Cu}=100\%-71,8\%=28,2\%\)

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
a_____2a_______a_____a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b_____2b______b_____b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}24a+56b=5,2\\a+b=\dfrac{3,36}{22,4}=0,15\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1\cdot24}{5,2}\cdot100\%\approx46,15\%\\\%m_{Fe}=53,85\%\\V_{ddHCl}=\dfrac{2\cdot\left(0,1+0,05\right)}{1}=0,3\left(l\right)\end{matrix}\right.\)
Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : Mg + 2HCl → MgCl2 + H2\(|\)
1 2 1 1
a 0,2 0,15
Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
b 0,1 0,15
a) Gọi a là số mol của Mg
b là số mol của Fe
Theo đề ta có : mMg + mFe = 5,2 (g)
⇒ nMg . MMg + nFe . MFe = 5,2 g
24a + 56b = 5,2g (1)
Theo đề ta có : 1a + 1b = 0,15 (2)
Từ (1),(2), ta có hệ phương trình :
24a + 56b = 5,2
1a + 1b = 0,15
⇒ \(\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
Khối lượng của magie
mMg = nMg . MMg
= 0,1 .24
= 2,4 (g)
Khối lượng của sắt
mFe = nFe . MFe
= 0,05 . 56
= 2,8 (g)
0/0Mg = \(\dfrac{m_{Mg}.100}{m_{hh}}=\dfrac{2,4.100}{5,2}=46,15\)0/0
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{2,8.100}{5,2}=53,85\)0/0
b) Số mol tổng của dung dịch axit clohidric
nHCl = 0,2 + 0,1
= 0,3 (mol)
Thể tích của dung dịch axit clohidric đã dùng
CMHCl = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,3}{1}=0,3\left(l\right)\)
Chúc bạn học tốt

\(n_{H_2}=0,15\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
a---------2a---------------------a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b---------2b-------------------b
\(\Rightarrow\left\{{}\begin{matrix}24a+56b=5,2\\a+b=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\%m_{Mg}=\dfrac{24.0,1.100\%}{5,2}\simeq46,15\%\\ \%m_{Fe}=100\%-46,15\%=53,85\%\)
\(n_{HCl}=2.0,1+2.0,05=0,3\left(mol\right)\\ V_{HCl}=\dfrac{n}{C_M}=\dfrac{0,3}{1}=0,3\left(l\right)=300\left(ml\right)\)

Đáp án D
Sơ đồ quá trình:
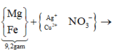
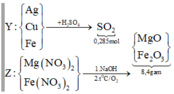
Gọi số mol Mg là x mol, Fe trong Y là y mol và Fe trong Z là z mol.
Ta có hệ phương trình:
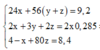
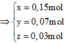
Theo đó, ![]()

nH2= 0,15(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
x______2x_______x________x(mol)
Fe+ 2 HCl ->FeCl2 + H2
y____2y______y___y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=5,2\\x+y=0,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
mMg=0,1.24=2,4(g)
=> \(\%mMg=\dfrac{2,4}{5,2}.100\approx46,154\%\\ \Rightarrow\%mFe\approx53,846\%\)

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\\ a,\%m_{Fe}=\dfrac{0,02.56}{4,36}.100\approx25,688\%\\ \Rightarrow\%m_{Ag}\approx74,312\%\\ b,Ta.thấy:2,18=\dfrac{1}{2}.4,36\\ \Rightarrow m_{hh\left(câuB\right)}=\dfrac{1}{2}.m_{hh\left(câuA\right)}\\ n_{Fe}=\dfrac{0,02}{2}=0,01\left(mol\right)\\ n_{Ag}=\dfrac{2,18-0,01.56}{108}=0,015\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ 2Ag+Cl_2\rightarrow\left(t^o\right)2AgCl\\ n_{Cl_2}=\dfrac{3}{2}.n_{Fe}+\dfrac{1}{2}.n_{Ag}=\dfrac{3}{2}.0,01+\dfrac{1}{2}.0,015=0,0225\left(mol\right)\\ \Rightarrow V_{Cl_2\left(đktc\right)}=0,0225.22,4=0,504\left(l\right)\)
chỉ vs ạ
\(n_{Mg}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_{hh}=24a+56b=18.8\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow a+b=0.45\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.25\)
\(\%Mg=\dfrac{0.2\cdot24}{18.8}\cdot100\%=25.53\%\)
\(\%Fe=100-25.53=77.47\%\)