Bài 3: Hoà tan hoàn toàn 8,8 gam một hỗn hợp gồm Magie và magie oxit bằng dung dịch axit HCL 4M thì thu được 4,48 lít khí Hidro( đo ở đktc). a/ Tính % khối lượng của magie và Magie oxit trong hỗn hợp ban đầu b/ Tính thể tích axit HCL tham gia phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
n Mg = n H2 = 2,24/22,4 = 0,1(mol)
%m Mg = 0,1.24/6,4 .100% = 37,5%
%m MgO = 100% -37,5% = 62,5%
b)
=> n MgO = (6,4 - 0,1.24)/40 = 0,1(mol)
=> n H2SO4 = n Mg + n MgO = 0,2(mol)
=> C% H2SO4 = 0,2.98/200 .100% = 9,8%
c)
n MgSO4 = n Mg + n MgO = 0,2(mol)
Sau phản ứng :
m dd = 6,4 + 200 - 0,1.2 = 206,2(gam)
C% MgSO4 = 0,2.120/206,2 .100% = 11,64%

a,
Số mol của H2 là :
nH2 = \(\dfrac{V}{22,4}\)= \(\dfrac{6,72}{22,4}\)= 0,3 ( mol )
PTHH
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2 \(\uparrow\) (1)
2 mol 6 mol 3 mol
0,2 mol 0,6 mol 0,3 mol
Khối lượng của Al trong hỗn hợp là
mAl= n.M = 0,2 . 27 = 5,4 ( g )
Khối lượng của MgO trong hỗn hợp là :
mMgO9= 9,4 - 5,4 = 4 ( g)
Thành phần % theo khối lượng của Al và MgO trong hỗn hợp là :
%Al = \(\dfrac{5,4}{9,4}\). 100 \(\approx\) 57,45 %
%MgO = \(\dfrac{4}{9,4}\). 100 \(\approx\) 42,55 %
b, Số mol của MgO là
nMgO= \(\dfrac{m}{M}\)= \(\dfrac{4}{40}\)= 0,1 (mol)
PTHH
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (2)
1mol 2 mol
0,1 mol 0,2 mol
Từ phương trình (1) và (2) suy ra số mol của HCl là
nHCl= 0,6 + 0,2 = 0,8 ( mol)
Thể tích HCl đã dùng là :
VHCl= \(\dfrac{n}{C_M}\) =\(\dfrac{0,8}{1,6}\) = 0,5 (l)

a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$MgO + 2HCl \to MgCl_2 + H_2O$
Theo PTHH : $n_{Al} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
$\%m_{Al} = \dfrac{0,2.27}{18,8}.100\% = 28,7\%$
$\%m_{MgO} = 100\% - 28,7\% =71,3\%$
b) $n_{MgO} = 0,335(mol)$
Theo PTHH : $n_{HCl} = 2n_{H_2} + 2n_{MgO} =1,27(mol)$
$V_{dd\ HCl} = \dfrac{1,27}{1,6} = 0,79375(lít)$
c)
$H_2 + O_{oxit} \to H_2O$
$\Rightarrow n_{O(oxit)} = n_{H_2} = 0,3(mol)$
$\Rightarrow n_{Fe} = \dfrac{17,4 - 0,3.16}{56} = 0,225(mol)$
Ta có :
$n_{Fe} : n_O = 0,225 : 0,3 = 3 : 4$
Vậy oxit là $Fe_3O_4$

a, PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
b, Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo ĐLBT KL, có: m oxit = mKL + mO2 = 15,6 + 0,2.32 = 22 (g)
c, Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\) (trong 15,6 g)
⇒ 24x + 27y = 15,6 (1)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}=\dfrac{1}{2}x+\dfrac{3}{4}y=0,2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=1,4\\y=-\dfrac{2}{3}\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.

Gọi nMg=a mol nAl=b mol
=>mcr=24a+27b=6,3 gam
Mg+2HCl=>MgCl2+H2
a mol =>a mol
2Al+6HCl=>2AlCl3+3H2
b mol =>1,5b mol
nH2=1,5b+a=0,3
=>b=0,1 mol a=0,15 mol
mMg=3,6 gam
mAl=2,7gam
Gọi CT oxit là M2On
nH2 + M2On => 2M + nH2O
0,3 mol=>0,3/n mol
n oxit=0,3/n mol
=>m oxit=0,3(2M+16n)=17,4n
=>M=21n
chọn n=8/3
=>M=56 CT oxit của M là Fe3O4

Gọi nMg=a mol nAl=b mol
=>mcr=24a+27b=6,3 gam
Mg+2HCl=>MgCl2+H2
a mol =>a mol
2Al+6HCl=>2AlCl3+3H2
b mol =>1,5b mol
nH2=1,5b+a=0,3
=>b=0,1 mol a=0,15 mol
mMg=3,6 gam
mAl=2,7gam
Gọi CT oxit là M2On
nH2 + M2On => 2M + nH2O
0,3 mol=>0,3/n mol
n oxit=0,3/n mol
=>m oxit=0,3(2M+16n)=17,4n
=>M=21n
chọn n=8/3
=>M=56 CT oxit của M là Fe3O4
Sai rồi nha bạn
-Nếu bạn gọi công thức oxit là M2On thì bạn đã bỏ qua trường hợp Fe3O4
-Nếu Công thức cần tìm là M2On thì chỉ số trước M phải là 2 mà ở đây công thức tìm được là Fe3O4 nên chỉ số trước M là 3 (không phù hợp)
- Phần chọn n = 8/3 chưa có 1 dẫn chứng nào để chứng tỏ n = 8/3

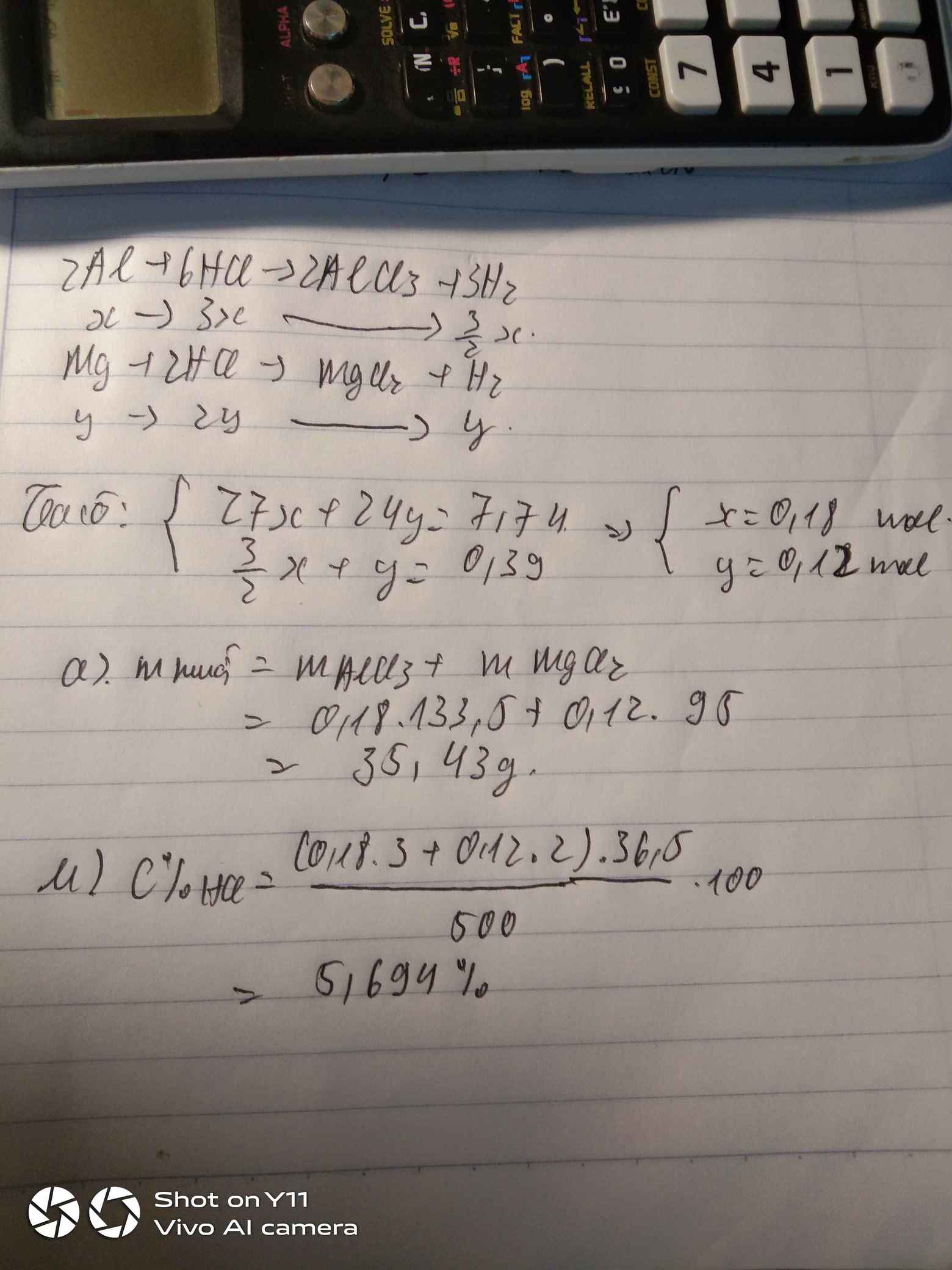

a) \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
_____0,2<---0,4<----0,2<----0,2
=> mMg = 0,2.24 = 4,8 (g)
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{4,8}{8,8}.100\%=54,55\%\\\%MgO=\dfrac{8,8-4,8}{8,8}.100\%=45,45\%\end{matrix}\right.\)
b) \(n_{MgO}=\dfrac{8,8-4,8}{40}=0,1\left(mol\right)\)
PTHH: MgO + 2HCl --> MgCl2 + H2O
______0,1--->0,2
=> nHCl = 0,2 + 0,4 = 0,6 (mol)
=> \(V_{ddHCl}=\dfrac{0,6}{4}=0,15\left(l\right)\)