Câu 1: Để m gam bột sắt ngoài không khí một thời gian thu được 6 gam hỗn hợp các chất rắn. Hòa tan hoàn toàn hỗn hợp đó bằng dung dịch HNO3 loãng thu được 1,12 lít khí NO duy nhất (đktc). Tính giá trị của m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có sơ đồ phản ứng :
Fe + O2 → Oxit , (Fe dư ) Fe(NO3) + NO + H2O
Gọi số mol Fe ban đầu là x mol , số mol oxi phản ứng là y mol
Fe → Fe+3 + 3e O2 +4e → 2O-2
N+5 + 3e → N+2
Áp dụng ĐLBT eletron ta có : 3x = 4y + 0,05.3 (1)
Áp dụng ĐLBT khối lượng : 56x + 32y = 6 (2)
Giải hệ pt gồm (1),(2) => x = 0,09 , y = 0,03
=> mFe = 0,09.56 = 5,04 gam

Quy đổi hỗn hợp thành : Fe ( x mol ) , O ( y mol )
\(m=56x+16y=12\left(g\right)\left(1\right)\)
Bảo toàn e :
\(3x=0.1\cdot3+2y\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.18,y=0.12\)
\(m_{Fe}=0.18\cdot56=10.08\cdot\left(g\right)\)
\(m_{Fe\left(NO_3\right)_3}=0.18\cdot242=43.56\left(g\right)\)

Đáp án B
Bảo toàn ne =>3nFe = 2nO + 3nNO => nO = 0,15 => m = mFe + mO = 8,4 + 0,15.16 = 10,8 => Chọn B.

Đáp án B
Bảo toàn ne =>3nFe = 2nO + 3nNO => nO = 0,15 => m = mFe + mO = 8,4 + 0,15.16 = 10,8 => Chọn B.

Đáp án : B
Z có : nCO = nCO2 = 0,03 mol
=> nO pứ = nCO pứ = 0,03 mol. Đặt nO dư = a
=> Coi Y gồm Kim loại và O dư a mol
=> m = (100/25).16(a + 0,03) = 64(a + 0,03)
=> nNO3 muối = 2a + 0,04.3 = 2a + 0,12 mol
=> 3,08.64(a + 0,03) = [64(a + 0,03) – 16(a + 0,03)] + 62(2a + 0,12)
=> a = 0,118 => m = 64( 0,118 + 0,03) = 9,472g

Đáp án B
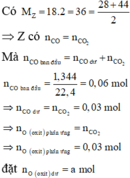
Quy đổi hỗn hợp Y tương ứng với hỗn hợp gồm các kim loại và O dư (a mol)
Có m O = 16 . ( a + 0 , 3 ) gam ⇒ m = 64 a + 1 , 92 ( 1 )
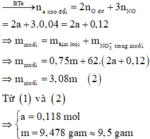
Vậy m gần với giá trị 9,5 nhất


Quy đổi hỗn hợp về Fe và O có số mol lần lượt là a;b(mol)
Theo gt: $n_{NO}=0,05(mol)$
Ta có: $56a+16b=6;3a-2b=0,15$
Giải hệ ta được $a=0,09;b=0,06$
Do đó bảo toàn nguyên tố Fe ta có: $m=5,04(g)$