Sục khí cacbonic vào dung dịch canxi hidro dư nêu hiện tượng và viết phương trình
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phenol có tính axit yếu, yếu hơn cả axit cacbonic. Vì vậy, axit cacbonic đẩy được phenol ra khỏi natri phenolat:
C 6 H 5 O N a + H 2 O + C O 2 → C 6 H 5 O H + N a H C O 3
Ở nhiệt độ thường, phenol rất ít tan trong nước, vì vậy, các phân tử phenol không tan làm cho dung dịch vẩn đục.
Ở nhiệt độ cao, phenol tan rất tốt trong nước (trên 70 ° C , tan vô hạn trong nước). Vì thế, khi đun nóng, phenol tan hết và dung dịch lại trong.

a. - Trích mẫu thử: Lấy ở mỗi lọ một lượng nhỏ ra ống nghiệm để nhận biết.
- Lấy dung dịch Na2CO3 cho vào mỗi ống trên:
+ Xuất hiện kết tủa trắng \(\Rightarrow\) Nhận biết được BaCl2.
BaCl2 + Na2CO3 \(\rightarrow\) BaCO3 \(\downarrow\)+ 2NaCl.
+ Có khí bay lên Þ Nhận biết được HCl:
2HCl + Na2CO3 \(\Rightarrow\) 2NaCl + CO2 + H2O.
+ Hai ống nghiệm không có hiện tượng gì chứa NaCl và Na2SO4.
- Dùng BaCl2 vừa nhận biết được ở trên cho vào hai mẫu chứa NaCl và Na2SO4:
+ Xuất hiện kết tủa trắng \(\Rightarrow\) Nhận biết được Na2SO4.
Na2SO4 + BaCl2 \(\rightarrow\) BaSO4\(\downarrow\) + 2NaCl.
+ Còn lại là NaCl.
b. Khi sục khí cacbonic vào dung dịch Ba(OH)2 đến dư, ban đầu xuất hiện kết tủa trắng, sau tan dần.
CO2 + Ba(OH)2 \(\rightarrow\) BaCO3\(\downarrow\) + H2O
CO2 + BaCO3 + H2O \(\rightarrow\) Ba(HCO3)2.
* Cho từ từ dung dịch HCl đến dư vào dung dịch NaOH loãng có chứa một lượng nhỏ phenolphtalein: dung dịch có màu hồng, sau nhạt dần đến mất hẳn.
HCl + NaOH \(\rightarrow\) NaCl + H2O.

a)
- Dung dịch nước vôi bị vẩn đục.
\(Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3+H_2O\)
b)
- Lúc đầu chưa có hiện tương, lúc sau sủi bọt khí không màu.
\(Na_2CO_3+HCl\rightarrow NaCl+NaHCO_3\)
\(NaHCO_3+HCl\rightarrow NaCl+CO_2+H_2O\)
c)
- Xuất hiện kết tủa keo trắng, kết tủa tan dần.
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)

Lúc đầu: C12H22O11 + H2SO4 → 12C(đen) + H2SO4.11H2O
Sau đó: C12H22O11 + 24H2SO4 → 12CO2↑ + 24SO2↑ + 35H2O
Khi nhỏ axit H2SO4 đặc vào saccarozo, ta thấy đường nhanh chóng hóa đen, sau đó khối rắn tăng thể tích rất nhanh và thoát khí mùi hắc (SO2). Quan sát phương trình ta thấy chỉ 1 mol đường nhưng tạo ra những (12 + 24 = 35) mol khí, vì vậy thể tích khối rắn tăng lên nhanh.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Khí (CO2 + SO2) sục vào dung dịch Ca(OH)2 dư ta thấy xuất hiện kết tủa trắng, kết tủa tăng dần đến tối đa và không thay đổi.

a) Thổi từ từ khí SO2 vào dd nước vôi trong Ca(OH)2.
+Thấy hiện tượng kết tủa trắng CaCO3 xuất hiện.
SO2+Ca(OH)2=>CaSO3+H2O
+Thổi tiếp khí SO2 vào dung dịch sau thì dd trong trở lại:
2SO2+Ca(OH)2=>Ca(HSO3)2
nhầm r ,hiện tượng đầu tiên là xh kết tủa trăng là CaSO3 chứ không phải CaCO3

CO2+Ca(OH)2->CaCO3+H2O
->Xuất hiện kết tủa trắng
CaCO3+CO2+H2O->Ca(HCO3)2
->Kết tủa trắng tan dần nếu CO2 dư vẫn sục vào

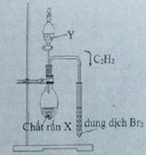
(X, Y) = (CaC2; H2O)
CH≡CH + Br2 → CH(Br2)–CH(Br2)
Dung dịch Br2 nâu đỏ dần nhạt màu rồi mất màu hoàn toàn

\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Hiện tượng: Dung dịch Brom màu da cam bị mất màu

lúc này đồng(II)oxit chuyển dần từ màu đen sang màu đỏ và có một vài giọt nước xung quang bình. Bột đỏ đấy là đồng
\(PTHH:CuO+H_2-^{t^o}>Cu+H_2O\)
- Xuất hiện kế tủa trắng:
\(Ca\left(OH\right)_2+CO_2->CaCO_3\downarrow+H_2O\)