Giúp mình
Bài 2 : Cho 10,5g hỗn hợp 2kim loại Cu,Zn vào dung dịch 500ml H2SO4 loãng dư,người ta thu được 2,24 lít khí (đktc).
a/ Viết phương trình hoá học.
b/Tính thành phần tram khối lượng mỗi kim loại trong hỗn hợp.
c/ Tính nồng độ mol dung dịch axit H2SO4.

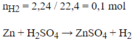

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,Zn+H_2SO_4\to ZnSO_4+H_2\\ b,n_{Zn}=0,1(mol)\Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow \%_{Zn}=\dfrac{6,5}{10,5}.100\%=61,9\%\\ \Rightarrow \%_{Cu}=100\%-61,9\%=38,1\%\\ c,n_{H_2SO_4}=0,1(mol)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
0.1 0.1
nH2= 2.24: 22.4=0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%Zn=6.5:10.5x100%=61.9%
%Cu=4:10.5x100%=38.1%