Khi đun nóng 22,12 gam KMnO4, thu được 21,16 gam hỗn hợp rắn. Tìm thể tích clo cực đại (đktc) có thể thu được khi cho hỗn hợp rắn đó tác dụng với HCl 36,5% (d = 1,18 g/ml). Tính thể tích của axit bị tiêu hao trong phản ứng đó.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 1:
a)
Gọi \(\left\{{}\begin{matrix}n_{Fe_2O_3}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
TH1: Al dư
PTHH: Fe2O3 + 2Al --to--> Al2O3 + 2Fe
a--->2a-------->a------->2a
=> B gồm \(\left\{{}\begin{matrix}Al_2O_3:a\left(mol\right)\\Fe:2a\left(mol\right)\\Al:b-2a\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
2a------------------------>2a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
(b-2a)------------------------>1,5(b - 2a)
=> 2a + 1,5b - 3a = 0,1
=> 1,5b - a = 0,1
Rắn không tan là Fe
=> \(n_{Fe}=2a=\dfrac{13,6}{56}=\dfrac{17}{70}\left(mol\right)\)
=> \(a=\dfrac{17}{140}\left(mol\right)\) => \(b=\dfrac{31}{210}\left(mol\right)\)
Xét \(n_{Al\left(dư\right)}=b-2a=\dfrac{-2}{21}\) (vô lí)
TH2: Fe2O3 dư
PTHH: Fe2O3 + 2Al --to--> Al2O3 + 2Fe
0,5b<---b--------->0,5b---->b
=> B gồm \(\left\{{}\begin{matrix}Al_2O_3:0,5b\left(mol\right)\\Fe:b\left(mol\right)\\Fe_2O_3:a-0,5b\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
b------------------------>b
=> b = 0,1
Rắn không tan gồm Fe và Fe2O3
=> \(56b+160\left(a-0,5b\right)=13,6\)
=> a = 0,1
A gồm \(\left\{{}\begin{matrix}Fe_2O_3:m_{Fe_2O_3}=0,1.160=16\left(g\right)\\Al:m_{Al}=0,1.27=2,7\left(g\right)\end{matrix}\right.\)
B gồm \(\left\{{}\begin{matrix}Al_2O_3:m_{Al_2O_3}=0,05.102=5,1\left(g\right)\\Fe:m_{Fe}=0,1.56=5,6\left(g\right)\\Fe_2O_3:m_{Fe_2O_3}=0,05.160=8\left(g\right)\end{matrix}\right.\)
b)
Rắn không tan gồm \(\left\{{}\begin{matrix}Fe:0,1\left(mol\right)\\Fe_2O_3:0,05\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1-->0,2
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
0,05---->0,3
=> nHCl = 0,2 + 0,3 = 0,5 (mol)
=> \(V_{ddHCl}=\dfrac{0,5}{0,5}=1\left(l\right)\)
Câu 2:
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1\left(mol\right)\)
Gọi số mol Al2O3 là x (mol)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,06<---------------------0,06<--------0,09
Al2O3 + 2NaOH --> 2NaAlO2 + H2O
x------------------>2x
2NaAlO2 + CO2 + 3H2O --> Na2CO3 + 2Al(OH)3
0,1<-------------------------------------0,1
=> 0,06 + 2x = 0,1
=> x = 0,02 (mol)
PTHH: 8Al + 3Fe3O4 --to--> 4Al2O3 + 9Fe
Có \(\dfrac{n_{Al_2O_3}}{n_{Fe}}=\dfrac{4}{9}\)
=> nFe = 0,045 (mol)
mY = mX = 11,98 (g)
=> \(m_{Al_2O_3}+m_{Al\left(Y\right)}+m_{Fe}+m_{Fe_3O_4\left(Y\right)}=11,98\)
=> \(m_{Fe_3O_4\left(Y\right)}=5,8\left(g\right)\)
=> \(n_{Fe_3O_4\left(Y\right)}=\dfrac{5,8}{232}=0,025\left(mol\right)\)
Bảo toàn Fe: \(n_{Fe_3O_4\left(bđ\right)}=0,04\left(mol\right)\)
Bảo toàn Al: nAl(bđ) = 0,1 (mol)
PTHH: 8Al + 3Fe3O4 --to--> 4Al2O3 + 9Fe
Xét tỉ lệ: \(\dfrac{0,1}{8}< \dfrac{0,04}{3}\) => Hiệu suất tính theo Al
PTHH: 8Al + 3Fe3O4 --to--> 4Al2O3 + 9Fe
0,04<------------------0,02
=> \(H\%=\dfrac{0,04}{0,1}.100\%=40\%\)

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

a)
Gọi $n_{Ag} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 108a + 56b = 16,4(1)$
$n_{NO_2} = 0,4(mol)$
Bảo toàn electron : $a + 3b = 0,4(2)$
Từ (1)(2) suy ra a = b = 0,1
$\%m_{Ag} = \dfrac{0,1.108}{16,4}.100\% = 65,85\%$
$\%m_{Fe} = 100\% -65,85\% = 34,15\%$
b)
$n_{HNO_3} = 2n_{NO_2} = 0,4.2 = 0,8(mol)$
$V_{dd\ HNO_3} = \dfrac{0,8}{1} = 0,8(lít)$

Đáp án D
Theo ĐL bảo toàn khối lượng:
m O 2 = 23 , 2 - 16 , 8 = 6 , 4 ( g )
→nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
O2- + 2H+ → H2O
0,4 0,8
VHCl = 0,8 : 2 = 0,4 (lít) = 400ml

Đáp án D
Theo Đl bảo toàn khối lượng:
![]()
→ nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
O2- + 2H+ → H2O
0,4 0,8
VHCl = 0,8 : 2 = 0,4 (lít) = 400ml

Đáp án B
Theo giả thiết, bảo toàn nguyên tố C và bảo toàn electron, ta có :
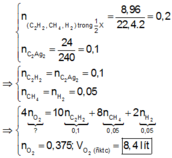
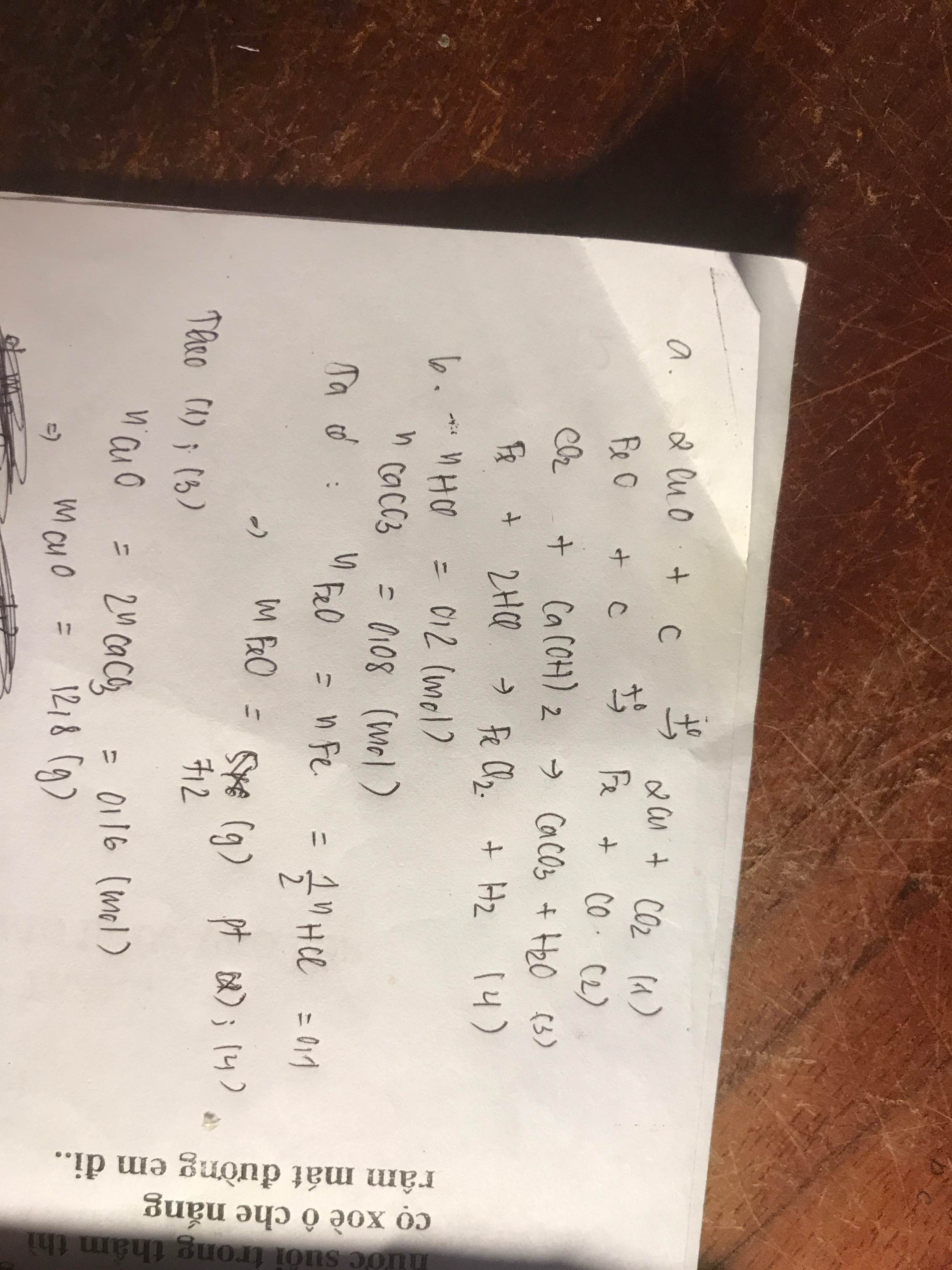





\(n_{KMnO_4}=\dfrac{22,12}{158}=0,14(mol)\\ PTHH:2KMnO_4\xrightarrow{t^o}K_2MnO_4+MnO_2+O_2\\ \Rightarrow m_{O_2}=m_{KMnO_4}-m_{\text{hh rắn}}=22,12-21,16=0,96(g)\\ \Rightarrow n_{O_2}=\dfrac{0,96}{32}=0,03(mol)\\ \Rightarrow n_{KMnO_4(dư)}=0,1-0,03.2=0,04(mol)\\ \Rightarrow n_{K_2MnO_4}=n_{MnO_2}=n_{O_2}=0,03(mol)\)
\(PTHH:\\ 2KMnO_4+16HCl\to 2KCl+MnCl_2+5Cl_2\uparrow+8H_2O\\ K_2MnO_4+8HCl\to 2KCl+MnCl_2+2Cl_2\uparrow+4H_2O\\ MnO_2+4HCl\to MnCl+Cl_2\uparrow+2H_2O\\ \Rightarrow \Sigma n_{Cl_2}=\dfrac{5}{2}.0,04+2.0,03+0,03=0,29(mol)\\ \Rightarrow V_{Cl_2}=0,29.22,4=6,496(l)\)