Hòa tan hoàn toàn 7,8 gam hỗn hợp X gồm Al và Mg trong 192,2 gam dung dịch HCl
dư, thu được dung dịch Y và giải phóng 8,96 lít khí H2 (đktc). Tính:
a. Thành phần phần trăm khối lượng của mỗi kim loại tỏng hỗn hợp đầu?
b. Nồng độ phần trăm của dung dịch axit HCl đã dùng?
c. Nồng độ phần trăm của dung dịch muối thu được?
giúp e với huhuhuhu







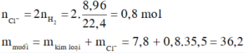
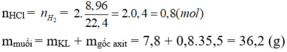
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ n_{Al}=x(mol);n_{Mg}=y(mol)\\ \Rightarrow 27x+24y=7,8(1)\\ a,2Al+6HCl\to 2AlCl_3+3H_2\\ Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow 1,5x+y=0,4(2)\\ (1)(2)\Rightarrow x=0,2(mol);y=0,1(mol)\\ \Rightarrow \%_{Al}=\dfrac{0,2.27}{7,8}.100\%=69,23\%\\ \Rightarrow \%_{Mg}=100\%-69,23\%=30,77\%\)
\(b,\Sigma n_{HCl}=3x+2y=0,8(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,8.36,5}{192,2}.100\%=15,19\%\\ c,n_{AlCl_3}=0,2(mol);n_{MgCl_2}=0,1(mol)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,2.133,5}{0,2.27+192,2-0,3.2}.100\%=13,55\%\\ C\%_{MgCl_2}=\dfrac{0,1.95}{0,1.24+192,2-0,1.2}.100\%=4,89\%\)