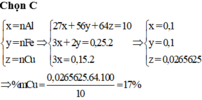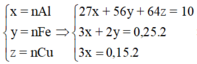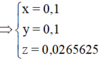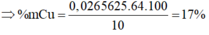Hỗn hợp X gồm Al , fe và Cu. chia a gam X thành 3 phần bằng nhau - Phần 1 cho tác dụng vào lượng dư dung dịch HCl thì thu được 5,6 lit khí H2 - phần 2 hòa tan hoàn toàn bằng lượng dư dung dịch H2SO4 đặc đun nóng thì thu được 7,84 lít khí SO2 (sản phẩm khử duy nhất) ,dung dịch y và chất rắn Z. Cho y tác dụng với lượng dư dung dịch NaOH thu được kết tủa T. Lọc lấy T đem nung trong không khí đến khối lượng không đổi thì thu được 12 g rắn G - phần 3 đốt cháy trong bình có chứa lượng dư khí Clo thu được b gam chất rắn E biết các phản ứng xảy ra hoàn toàn. Tính giá trị của a và b Làm hộ em với ạ!!!。゚( ゚^∀^゚)゚。
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Xét P2 : Chỉ có Al phản ứng với NaOH => nAl.3 = 2nH\(_2\) ( Bảo toàn e)
=> nAl = 0,1 mol
Xét P1 : Fe và Al phản ứng với HCl đặc => 2nFe + 3nAl = 2nH\(_2\)
=> nFe = 0,1 mol
=> Trong mỗi phần thì có : mCu = \(\dfrac{1}{2}.10-27.0,1-56.0,1=1,7\left(g\right)\)
\(\%m_{Cu\left(X\right)}=\%m_{Cu\left(1/2X\right)}=17\%\)

a)2Al+6HCl→2AlCl3+3H2
Fe+2HCl→FeCl2+H2
2Al+6H2SO4→Al2(SO4)3+3SO2+6H2O
2Fe+6H2SO4→Fe2(SO4)3+3SO2+6H2O
Cu+2H2SO4→CuSO4+SO2+2H2O
hh:Al(amol),Fe(bmol),Cu(cmol)
nNaOH=0,2×2=0,4mol
nHCl=0,4×2=0,8mol
⇒nHClpu=0,8−0,4=0,4mol
nSO2=5,6\22,4=0,25mol
27a+56b+64c=14,2
0,5a×3+0,5b×2=0,4
0,5a×1,5+0,5b×1,5+0,5c=0,25
⇒a=0,2;b=0,1;c=0,05
mAl=0,2×27=5,4g
mFe=0,1×56=5,6g
mCu=0,05×64=3,2g
b)mddspu=7,1+50−0,25×64=41,1g
C%Al2(SO4)3=41,6%
C%Fe2(SO4)3=24,33%
C%CuSO4=9,73%

- Phần 1: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a--------------------------->1,5a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b--------------------------->b
\(\Rightarrow1,5a+b=0,06\left(1\right)\)
- Phần 2: Đặt hệ số tỉ lệ \(\dfrac{P_2}{P_1}=k\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=ak\left(mol\right)\\n_{Fe}=bk\left(mol\right)\end{matrix}\right.\Rightarrow ak+bk=0,15\left(2\right)\)
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PTHH: \(2Al+2KOH+2H_2O\rightarrow2KAlO_2+3H_2\)
0,06<----------------------------------------0,09
\(\Rightarrow ak=0,06\left(3\right)\)
Từ \(\left(1\right),\left(2\right),\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\\k=3\end{matrix}\right.\)
\(\Rightarrow m=\left(0,02.27+0,03.56\right)\left(3+1\right)=8,88\left(g\right)\)