Cho dd BaCl2 tác dụng với H2SO4 có kết tủa gì?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


600ml = 0,6l
600ml = 0,6l
\(n_{H2SO4}=1.0,6=0,6\left(mol\right)\)
\(n_{BaCl2}=0,5.0,6=0,3\left(mol\right)\)
Pt : \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4|\)
1 1 2 1
0,6 0,3 0,6 0,3
a) Lập tỉ số so sánh : \(\dfrac{0,6}{1}>\dfrac{0,3}{1}\)
⇒ H2SO4 dư , BaCl2 phản ứng hết
⇒ Tính toán dựa vào số mol của BaCl2
\(n_{BaSO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
⇒ \(m_{BaSO4}=0,3.233=69,9\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,3.2}{1}=0,6\left(mol\right)\)
\(n_{H2SO4\left(dư\right)}=0,6-0,3=0,3\left(mol\right)\)
\(V_{ddspu}=0,6+0,6=1,2\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0,6}{1,2}=0,5\left(M\right)\)
\(C_{M_{H2SO4\left(dư\right)}}=\dfrac{0,3}{1,2}=0,25\left(M\right)\)
Chúc bạn học tốt

\(n_{BaCl_2}=\dfrac{200.20,8\%}{208}=0,2\left(mol\right)\\ PTHH:BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\\ n_{BaSO_4}=n_{H_2SO_4}=n_{BaCl_2}=0,2\left(mol\right)\\ a,m_{kt}=m_{BaSO_4}=233.0,2=46,6\left(g\right)\\ b,C\%_{ddH_2SO_4}=\dfrac{0,2.98}{200}.100\%=9,8\%\)

\(a,m_{BaCl_2}=\dfrac{200.20,8\%}{100\%}=41,6g\\ n_{BaCl_2}=\dfrac{41,6}{208}=0,2mol\\ BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\\ n_{BaSO_4}=n_{H_2SO_4}=n_{BaCl_2}=0,2mol\\ m_{\downarrow}=m_{BaSO_4}=0,2.233=46,6g\\ b,m_{H_2SO_4}=0,2.98=19,6g\\ C_{\%H_2SO_4}=\dfrac{19,6}{200}\cdot100\%=9,8\%\)

\(n_{H_2}=\dfrac{2,464}{22,4}=0,11mol\)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow Muối\left\{{}\begin{matrix}Al_2\left(SO_4\right)_3\\FeSO_4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}BTe:3x+2y=2n_{H_2}=0,22\\\dfrac{x}{2}\cdot342+y\cdot152=14,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04mol\\y=0,05mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,04\cdot27=1,08g\\m_{Fe}=0,05\cdot56=2,8g\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_4\downarrow\)
0,02 0,06
\(FeSO_4+BaCl_2\rightarrow BaSO_4\downarrow+FeCl_2\)
0,05 0,05
\(\Rightarrow\Sigma n_{\downarrow}=0,06+0,05=0,11\Rightarrow m_{BaSO_4}=x=25,63g\)

a) Gọi số mol hai axit HCl và H2SO4 lần lượt là a và b
Thí nghiệm 1:
HCl + AgNO3 → AgCl + HNO3
nAgCl = \(\dfrac{2,87}{108+35,5}=0,02\) mol = nHCl = a
→ Nồng độ mol của dung dịch axit HCl là \(\dfrac{0,02}{0,05}=0,4\)M
Thí nghiệm 2:
BaCl2 + H2SO4 → BaSO4 + 2HCl
nBaSO4 = \(\dfrac{4,66}{137+96}=0,02\) mol = nH2SO4
→ Nồng độ mol của dung dịch H2SO4 là \(\dfrac{0,02}{0,05}=0,4\)M
b) Trung hoà dung dịch X bằng NaOH
HCl + NaOH → NaCl + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
→ nNaOH = nHCl + 2nH2SO4 = 0,02 + 2.0,02 = 0,06 mol
→ Thể tích dung dịch NaOH = 0,06/0,2 = 0,3 lít = 300 ml
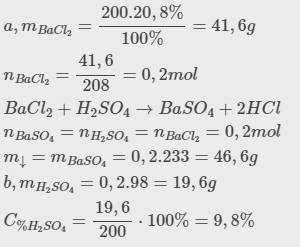
TL :
Kết tủa là nó sẽ có màu trắng
HT
@@@@@@@@@@@@@@@
Cho dd BaCl2 tác dụng với H2SO4 có kết tủa gì?
Trả lời :
Cho dd BaCl2 tác dụng với H2SO4 có kết tủa màu trắng ( BaSO4 )
HT