Cho kim loại Al phản ứng hết với 100 ml dung dịch HNO3, kết thúc phản ứng thu được 6,72 lít khí N2 (đktc) (sản phẩm khử duy nhất). Viết phương trình phản ứng xảy ra. Tính khối lượng Al phản ứng và nồng độ mol dung dịch HNO3.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


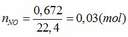
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
a → 4a → a → a (mol)
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O (2)
B → 8/3b → b →2/3b (mol)
TH1: xảy ra phản ứng (1) tạo muối Fe(NO3)3 => nFe(NO3)3 = nNO = 0,03 (mol)
=> mmuối = mFe(NO3)3 = 0,03. 242 = 7,26 (g) # 7,82 => loại
TH2: xảy ra phản ứng (2) tạo muối Fe(NO3)2 => nFe(NO3)2 = 3/2 nNO = 3/2 . 0,03 = 0,045 (mol)
=> mmuối = mFe(NO3)2 = 0,045. 180 = 8,1 (g) # 7,82 => loại
TH3: xảy ra cả (1) và (2) phản ứng tạo 2 muối.
Gọi số mol của Fe ở phản ứng (1) và (2) lần lượt là a và b (mol)
Đặt vào phương trình ta có:
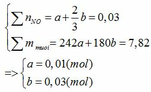
∑ nFe = 0,01 + 0,03 = 0,04 (mol) => mFe = 0,04.56 = 2,24 (g)
∑ nHNO3 pư = 4a + 8/3b = 4. 0,01 + 8/3. 0,03 = 0,12 (mol)
mHNO3 = 0,12.63 = 7,56 (g)
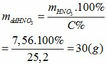
Khối lượng dd sau: mdd sau = mFe + mddHNO3 - mNO = 2,24 + 30 – 0,03.30 = 31,34 (g)
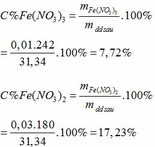

Cách 1:
\(8Al+30HNO_3\rightarrow8Al\left(NO_3\right)_3+3N_2O+15H_2O\\ n_{N_2O}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Al}=\dfrac{8}{3}.0,15=0,4\left(mol\right)\\ m_{Al}=0,4.27=10,8\left(g\right)\\ n_{HNO_3}=\dfrac{30}{3}.0,15=1,5\left(mol\right)\\ m_{HNO_3}=63.1,5=94,5\left(g\right)\\ \)
Cách 2: Làm bằng trao đổi e ấy.

Đáp án C
Phản ứng hoàn toàn thu được
sản phẩm + KOH ⇒ H2 ⇒ Al dư.
Ta có phản ứng:
8Al + 3Fe3O4 ![]() 4Al2O3 + 9Fe.
4Al2O3 + 9Fe.
Với nAl dư = 2nH2÷3 = 0,02 mol.
Xem hỗn hợp X gồm: nAl = 0,02
nAl2O3 = a || nFe = b ta có:
PT bảo toàn e với SO2:
3nAl + 3nFe = 2nSO2
Û nFe = b = 0,0225
⇒ nAl2O3 = 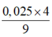 = 0,01.
= 0,01.
Bảo toàn khối lượng
mHỗn hợp ban đầu = mAl + mAl2O3 + mFe
= 2,82 gam.
Bảo toàn nguyên tố Al
⇒ ∑nAl ban đầu = 0,02 + 0,01×2 = 0,04 mol.
⇒ %mAl = 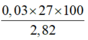
= 38,298%

a)
nSO2=\(\dfrac{10,08}{22,4}\)= 0,45(mol)
2Al + 6H2SO4 --> Al2(SO4)3 + 6H2O +3SO2
x ---------------------------------------------> 3/2x
2Fe + 6H2SO4 --> Fe2(SO4)3 + 6H2O + 3SO2
y --------------------------------------------------> 3/2y
b) ta có hệ pt sau
\(\left\{{}\begin{matrix}27x+56y=11\\\dfrac{3}{2}x+\dfrac{3}{2}y=0,45\end{matrix}\right.\)
\(\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
%mAl = \(\dfrac{0,2.27}{11}.100\)= 49%
%mFe=\(49-100\) =51%
c) m Al2(SO4)3= 0,1.342=34,2 g
mFe2(SO4)3=0,05.400=20 g

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,1}=6\left(M\right)\)






\(10Al+36HNO_3\rightarrow10Al\left(NO_3\right)_3+3N_2+H_2O\)
\(n_{N_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
Bảo toàn e :
\(n_{Al}=\dfrac{10\cdot n_{N_2}}{3}=\dfrac{10}{3}\cdot0.3=1\left(mol\right)\)
\(m_{Al}=1\cdot27=27\left(g\right)\)
\(n_{HNO_3}=12n_{N_2}=12\cdot0.3=3.6\left(mol\right)\)
\(C_{M_{HNO_3}}=\dfrac{3.6}{0.1}=36\left(M\right)\)