Câu 31: Cho 80ml dung dịch HCl 0,5M tác dụng với 100ml dung dịch NaOH 0,5M, sau đó nhúng quỳ tím vào dung dịch thu được. Quỳ tím sẽ:
A. chuyển đỏ B. chuyển xanh C. mất màu D. Không đổi màu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

B đúng.
nHBr = 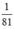 mol
mol
nNaOH = 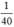 mol
mol
NaOH + HBr → NaBr + H2O
nNaOH > nHBr (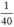 >
> 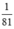 ) ⇒ sau phản ứng NaOH dư
) ⇒ sau phản ứng NaOH dư
⇒ nhúng giấy quỳ vào dung dịch thu được giấy quỳ sẽ chuyển màu xanh

\(n_{NaOH}=2.0,2=0,4\left(mol\right)\\ n_{HCl}=0,2.1=0,2\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ Vì:\dfrac{0,2}{1}< \dfrac{0,4}{1}\Rightarrow NaOHdư\)
=> Quỳ tím hoá xanh => C

nFe=0.1(mol) nCa(OH)2=0.1(mol).Do sau phản ứng một,dd làm quỳ đổi màu đỏ->axit dư
pthh:Fe+H2SO4->FeSO4+H2(1)
H2SO4+Ca(OH)2->CaSO4+2H2O(2)
theo pthh(1):nFe=nH2SO4(1)->nH2SO4(1)=0.1(mol)
theo pthh(2):nCa(OH)2=nH2SO4(2)->nH2SO4(2)=0.1(mol)
Tổng nH2SO4 ở cả 2pt:0.1+0.1=0.2(mol)
mH2SO4=98*0.2=19.6(g)

\(a)n_{NaOH}=0,5.0,2=0,1mol\\ n_{H_2SO_4}=0,3.1=0,3mol\\2 NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,1}{2}< \dfrac{0,3}{1}\Rightarrow H_2SO_4.dư\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,1 0,05 0,05 0,1
\(C_M\) \(_{Na_2SO_4}=\dfrac{0,05}{0,2+0,3}=0,1M\)
\(C_M\) \(_{H_2SO_4}=\dfrac{0,3-0,05}{0,2+0,3}=0,5M\)
b) Vì H2SO4 dư nên quỳ tím hoá đỏ.

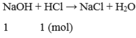
Sau phản ứng dung dịch thu được chỉ chứa NaCl, vậy dung dịch sau phản ứng không làm quỳ tím đổi màu.
Chọn đáp án C
Chọn D
HCl tác dụng với NaOH tạo ra muối và không làm đổi màu quỳ tím
B. Xanh
\(n_{HCl}=0,08 . 0,5=0,04 mol\)
\(n_{NaOH}=0,1. 0,5=0,05 mol\)
Làm bài toán hết dư nhé
\(NaOH + HCl \rightarrow NaCl + H_2O\)
Trước pư: 0,05 0,04
PƯ: 0,04 0,04
Sau pư: 0,01 0
Sau pư, HCl hết, NaOH dư nên dd sau pư làm quỳ tím chuyển xanh